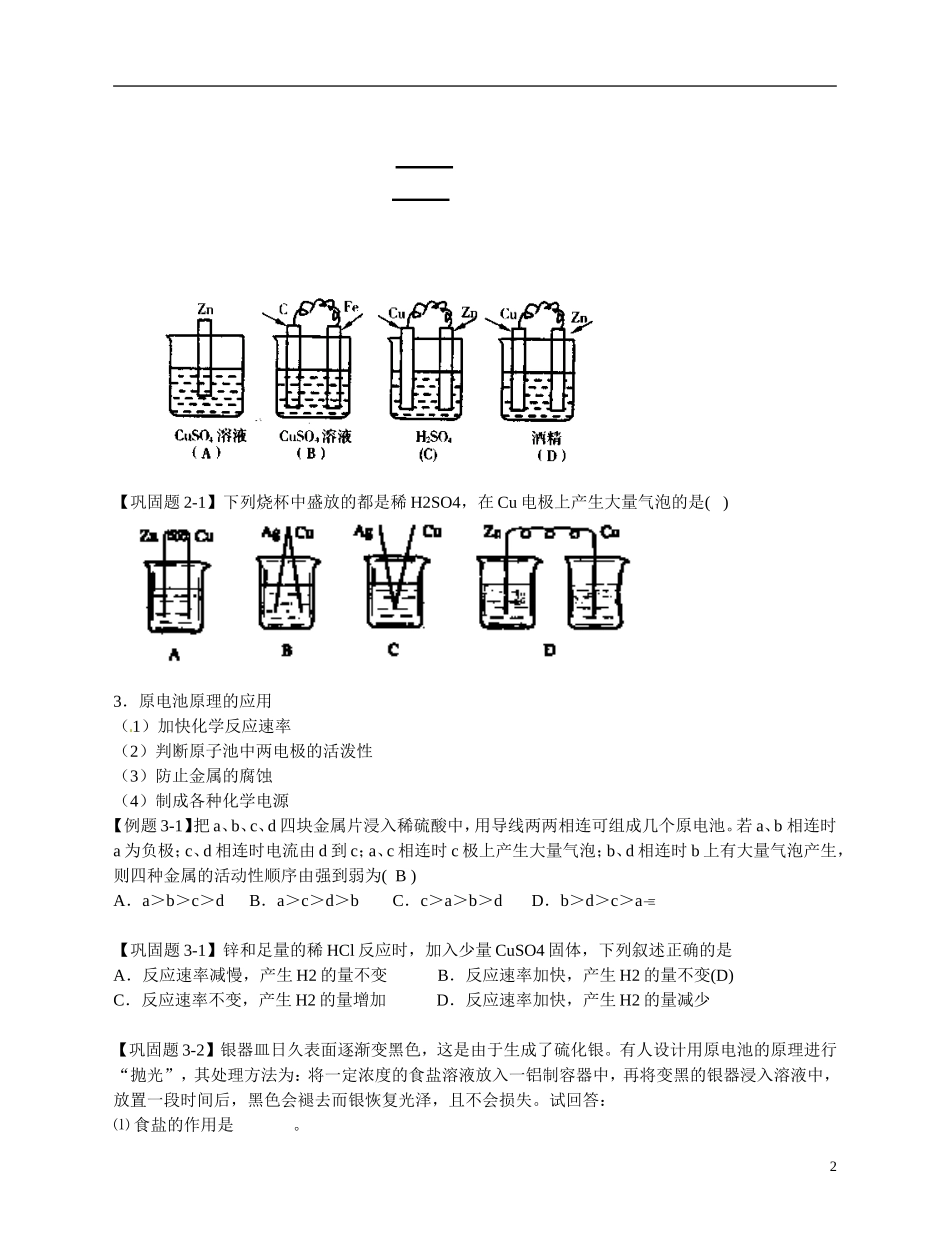
福建省漳州市芗城中学高二化学 原电池复习课教学案【学习目标】1.理解原电池原理;了解金属的电化学腐蚀。2.了解日常生活中常用的化学电源和新型化学电池。【学习重点】原电池原理课时安排:2 课时【学习内容】1.原电池的化学原理原电池是_______________________________________________________________________的装置。根据原电池两极的活泼性不同,将原电池两极分为__________和__________。正极和负极正极:通常是活泼性较 的金属或非金属导体,电子流 (填“出”或“入”)的一极,电极上发生________(填“氧化”或“还原”反应)。负极:通常是活泼性较 的金属,电子流 (填“出”或“入”)的一极,电极被______(填“氧化”或“还原”),电极发生______反应(填“氧化”或“还原”)。【例题 1-1】下列关于原电池的叙述中正确的是 A ( )A.原电池能将化学能转变为电能B.原电池负极发生的电极反应是还原反应C.原电池在工作时其正极不断产生电子并经外电路流向负极D.原电池的电极只能由两种不同的金属构成【巩固题 1-1】在如图所示的装置中,a 的金属性比氢要强,b 为碳棒,关于此装置的各种叙述不正确的是( )A.碳棒上有气体放出,溶液 pH 变大B.a 是正极,b 是负极 C.导线中有电子流动,电流从 a 极到 b 极D.a 极上发生了氧化反应【巩固题 1-2】碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)下列说法错误的是( )A.电池工作时,锌失去电子B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq)C.电池工作时,电子由正极通过外电路流向负极D.外电路中每通过 0.2mol 电子,锌的质量理论上减小 6.5g2.原电池的形成条件(1)活泼性不同的电极材料(金属与金属或金属与非金属导体)(2)电解质溶液(3)构成闭合电路(用导线连接或直接接触)【例题 2-1】下列装置属于原电池的是1 【巩固题 2-1】下列烧杯中盛放的都是稀 H2SO4,在 Cu 电极上产生大量气泡的是( ) 3.原电池原理的应用(1)加快化学反应速率(2)判断原子池中两电极的活泼性(3)防止金属的腐蚀(4)制成各种化学电源【例题 3-1】把 a、b、c、d 四块金属片浸入稀硫酸中,用导线两两相连可组成几个原电池。若 a、b 相连时a 为负极;c、d 相连时电流由 d 到 c;a、c 相连时 ...