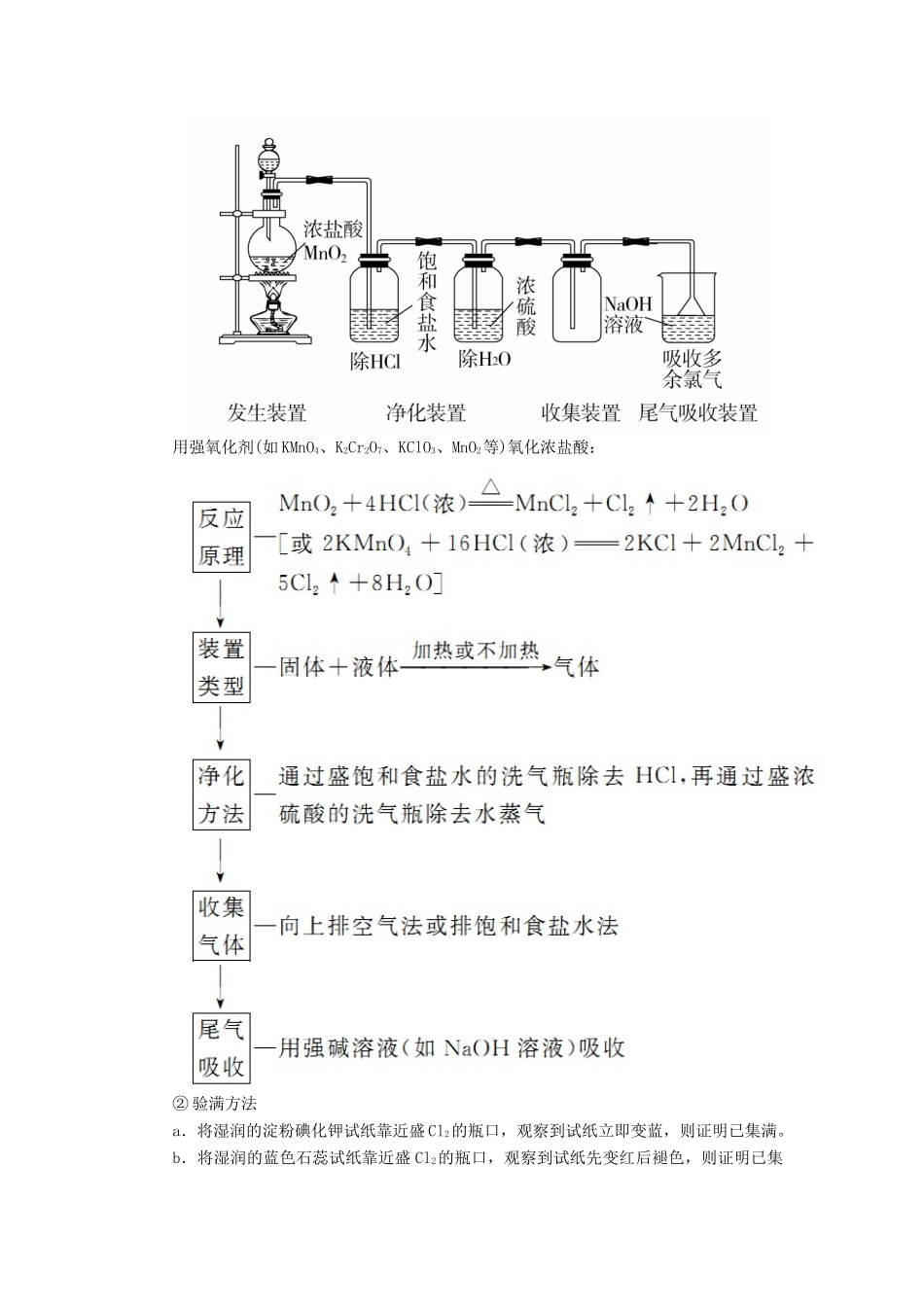
专题十七 氯、溴、碘及其化合物考纲展示 命题探究1 氯气的性质(1)氯元素的原子结构氯元素位于元素周期表中第三周期Ⅶ A 族,原子结构示意图为,最外层有 7 个电子,在化学反应中易获得 1 个电子而表现为-1 价。自然界中氯主要以化合态形式存在。(2)物理性质颜色状态气味密度毒性溶解性黄绿色气体刺激性比空气大有毒1 体积水溶解 2 体积 Cl2(3)氯气的性质性质化学方程式与金属反应(与变价金属反应,均生成高价态)2Na+Cl2=====2NaCl(产生白烟)Cu+Cl2=====CuCl2(产生棕黄色的烟)2Fe+3Cl2=====2FeCl3(产生棕色的烟)续表性质化学方程式与非金属反应H2+Cl2=====2HCl(发出苍白色火焰,有白雾生成)2P+3Cl2(不足)=====2PCl3;2P+5Cl2(足量)=====2PCl5(足量)与水反应Cl2+H2O===HCl+HClO与碱反应Cl2+2NaOH===NaCl+NaClO+H2O(用于除去多余的氯气)2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O(用于制漂粉精)与某些还原性物质2FeCl2+Cl2===2FeCl3反应2KI+Cl2===2KCl+I2(使湿润的淀粉KI 试纸变蓝色,用于氯气的检验)SO2+Cl2+2H2O===2HCl+H2SO4与某些有机物反应CH4+Cl2――→CH3Cl+HCl(取代反应)CH2===CH2+Cl2―→CH2ClCH2Cl(加成反应)学霸巧学卡(1)图解氯气的性质(2)Cl2与变价金属反应,均生成高价态金属氯化物。(3)氯气与水的反应中,氯气既作氧化剂又作还原剂: (4)常温下干燥的氯气或液氯均不与铁反应,故液氯通常储存在钢瓶中。(5)Cl2的用途:重要的化工原料,可用于制盐酸、漂白粉、含氯有机物等。2 氯气的制法(1)工业制法——电解法2NaCl+2H2O=====2NaOH+H2↑+Cl2↑(2)实验室制法① 实验装置用强氧化剂(如 KMnO4、K2Cr2O7、KClO3、MnO2等)氧化浓盐酸:② 验满方法a.将湿润的淀粉碘化钾试纸靠近盛 Cl2的瓶口,观察到试纸立即变蓝,则证明已集满。b.将湿润的蓝色石蕊试纸靠近盛 Cl2的瓶口,观察到试纸先变红后褪色,则证明已集满。c.实验室制取 Cl2时,也常常根据集气瓶中气体的颜色来判断是否集满。学霸巧学卡(1)反应物的选择:必须用浓盐酸,稀盐酸与 MnO2不反应,且随着反应的进行,浓盐酸变为稀盐酸时,反应停止,故盐酸中的 HCl 不可能全部参加反应。(2)加热温度:不宜过高,以减少 HCl 挥发。(3)尾气吸收:Cl2有毒,必须有尾气吸收装置,常用吸收剂为 NaOH 溶液或碱石灰,不用澄清石灰水,因澄清石灰水中 Ca(OH)2浓度小,吸收慢且吸收不完全。(4)实验结束后,先排出残留的 Cl2,再拆卸装置,避...