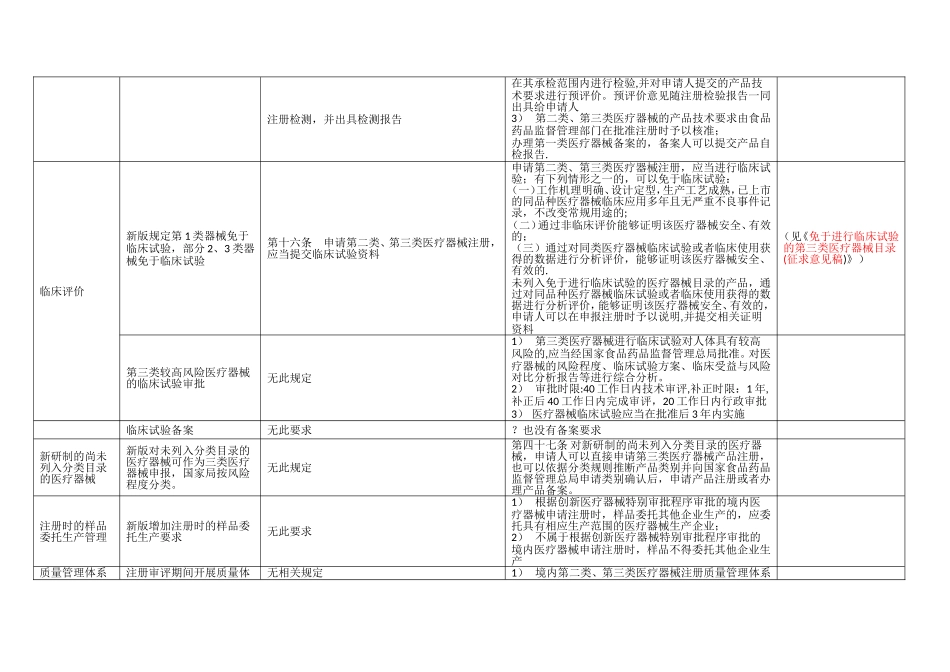
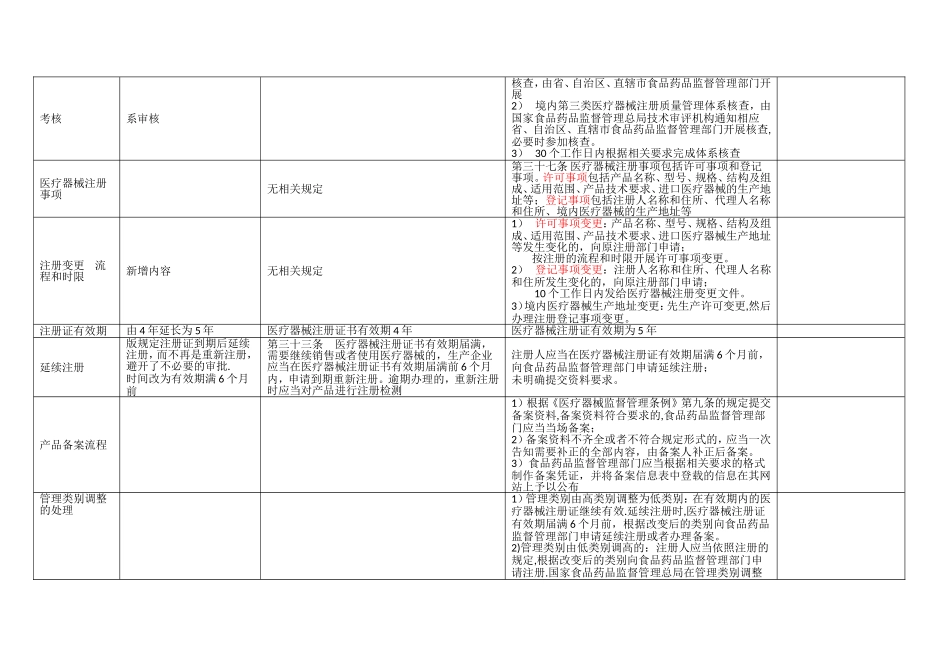
《医疗器械注册管理办法》新(2025 局令第 4 号)与旧(2025 局令第 16 号)版法规对比项目对比旧版(2025 局令第 16 号)新版(2025 局令第 4 号)备注医疗器械管理方式新版规定境内第 1 类器械由注册改为备案管理;第2、3 类器械仍实行注册管理第四条 国家对医疗器械实行分类注册管理第五条 第一类医疗器械实行备案管理。 第二类、第三类医疗器械实行注册管理。产品注册流程注册审评期间开展质量体系审核产品研制注册检验临床试验体系考核产品注册审评行政审批—发证产品研制注册检验临床试验产品注册审评体系考核行政审批-发证第三十四条 食品药品监督管理部门在组织产品技术审评时可以调阅原始讨论资料,并组织对申请人进行与产品研制、生产有关的质量管理体系核查审批时限新旧版审批中补正材料和补正后审评时限不同,2025 版规定补正材料时间 1 年内,补正后审评时间 60 工作日时限=形式审查(5 日)+技术审评(90 日)+补正材料(60 日)+专家评审+行政审批(10 日) 共≈8 个自然月(专家评审时间不计在内)时限=形式审查(5 日)+技术审评(90 日)+专家评审+补正材料(1 年内)+补正后审评(60 日)+行政审批(20日+10 日) 共≈21 个自然月(体系考核 30 工作日、专家评审时间不计在内)注册(备案)申报资料新版未明确申报资料要求境内第二类、第三类医疗器械注册申请材料要求 1 境内医疗器械注册申请表;2 医疗器械生产企业资格证明:3 产品技术报告:4 安全风险分析报告:5 适用的产品标准及说明:6 产品性能自测报告:7 医疗器械检测机构出具的产品注册检测报告8 医疗器械临床试验资料9 医疗器械说明书;10 产品生产质量体系考核(认证)的有效证明文件; 11 所提交材料真实性的自我保证声明第三十一条 申请医疗器械注册,申请人应当根据相关要求向食品药品监督管理部门报送申报资料。产品技术要求和注册检验1)“产品标准”更名为“产品技术要求” 2)产品技术要求涵盖内容精简3)新增预评价要求第十条 医疗器械检测机构应当在国家食品药品监督管理局和国家质量监督检验检疫总局认可的检测范围内,依据生产企业申报适用的产品标准(包括适用的国家标准、行业标准或者生产企业制定的注册产品标准)对申报产品进行1) 产品技术要求主要包括医疗器械成品的性能指标和检验方法,其中性能指标是指可进行客观判定的成品的功能性、安全性指标以及与质量控制相关的其他指标。 2) 医疗器...