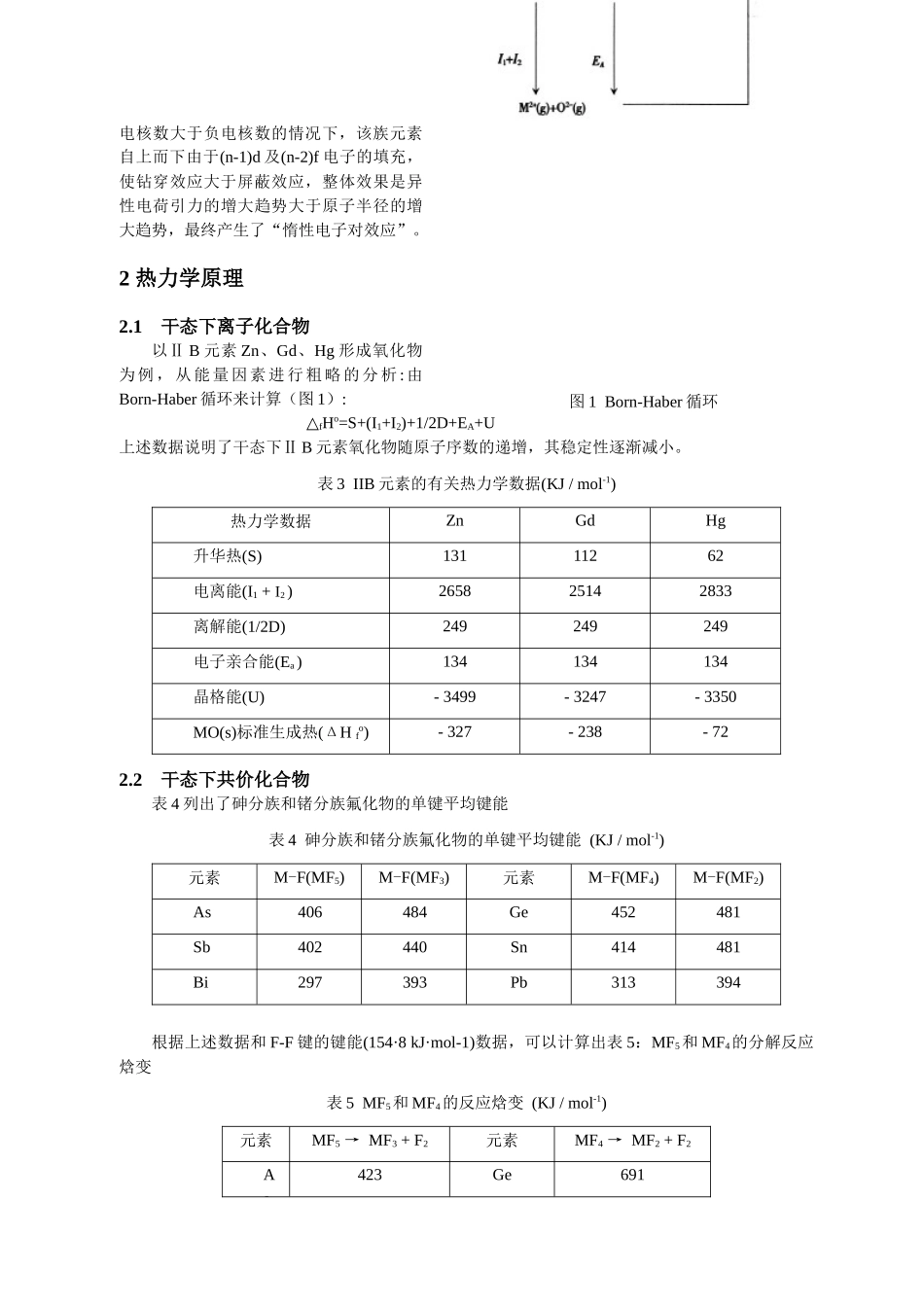
对惰性电子对效应产生的原因的理解王友梅(2007210350)(华中师范大学化学学院,武汉,430079)摘要:关于惰性电子对效应的产生原因目前有各种不同的解释。本文从原子结构理论、热力学理论和相对论性效应三个方面的原因进行理解的。关键词:惰性电子对效应原子结构理论热力学原理相对论性效应周期表中p区下方的金属元素,即Tl、Pb、Bi和Po在化合物中的特征氧化态表现“反常”,他们的低价氧化态化合物,即Tl(I)、Pb(II)、Bi(Ⅲ)和Po(Ⅳ)的化合物最稳定。如表1:P区金属元素氧化态的变化(6s2的稳定性)。表1几种元素的价电子结构与氧化数ns2np1ns2np2ns2np3ns2np4Ga+I,+IIIGe+II,ⅣAs+Ⅲ,+ⅤIn+I,+IIISn+II,ⅣSb+Ⅲ,+ⅤTl+IPb+IIBi+ⅢPoⅣ长期以来,学者们认为这是由于这四种元素存在6s2惰性电子对的之故。这种现象为西奇威克最先注意到,并称之为“惰性电子对效应”。“惰性电子对效应”比较直观的解释了上述现象,但对本质没有加以阐明。我是从原子结构理论、热力学理论和相对论性效应三个方面进行理解的。1原子结构理论西奇威克(NVsigdwick)等人认为轻重元素与族数相同的高氧化态不稳定是由于刚充满的d(或f)亚层的屏蔽作用较弱,价电子受到核引力较强,故在失去np电子之后,一对强穿透力的ns电子就极难失去了。德拉戈(R·S·Drago)等人反对上述观点,认为不存在什么惰性电子对,他们提出的原因是:第一,壳层效应较重元素的价层轨道的重迭程度较差。第二,全满d(和f)亚层强烈排斥键合原子的原子实,结果使重元素价层轨道不能充分参与成键,随着原子序数的增大,此效应愈大,以至高氧化态愈难显现,低氧化态都相对稳定了。所谓“原子结构”,在化学研究领域内,主要是讨论原子核外的电子排布情况。为便于讨论现以VA族元素为例,将其原子与价电子电离有关的外围电子排布情况列于表2。我们知道,基态原子外层电子填充顺序为→ns→(n-2)f→(n-1)d→np所以,表2是按电子填充顺序排列的。但通过对基态原子和离子内轨道能级的研究,从大量光谱数据中总结出的经验规律可知,价电子电离顺序为→np→ns→(n-1)d→(n-2)f因此,在氧化值为+3的化合物中,该族元素原子的电子排布可视为np轨道全空(共价化合物中共用电子对只是偏移),ns轨道全满。即表2最右一栏全空。在此我们从以下几方面对该族元素在氧化值为+3时的化合物中的结构特点进行分析。表2VA族元素原子外围电子排布情况(1)单从电子层结构角度看,同族元素自上而下,电子层逐渐增多,其原子半径逐渐增大,最外层电子受原子核的引力减弱。鉴于此因,一般说来,某些具有变价性的元素形成高氧化态化合物的趋势增大,理论上讲其高价氧化物的稳定性应增强。(2)由表2可知,第2、3周期(即N、P)元素只有S电子和P电子,而第4、5周期(即As、Sb)元素增添了(n-1)d电子,第6周期(即Bi)元素进而又增添了(n-2)f电子。由于(n-1)d和(n-2)f电子分别填充在次外层或倒数第3层上,同时,这些电子亚层恰又属全满状态的稳定结构,因此,核外电子受核电荷引力增强,致使As、Sb尤其是Bi元素原子半径相对于这些原子未填充(n-1)d或(n-2)f电子状态的半径增大趋势较小。再则,Bi元素在(n-2)f电子的填充过程中,经过了镧系收缩,其半径的增大趋势则相对更小。由此可见,该族元素氧化值由+3变为+5的总趋势从P到Bi逐渐变小,尤其Bi元素则更小。(3)在讨论原子结构时,不可忽视的因素有两种效应———屏蔽效应和钻穿效应。我们知道d、f电子云相对于s、p电子云分布较分散,周围空隙较多,其本身的屏蔽效应较差,而其外层的s、p电子的钻穿效应则显得较强。由于As、Sb、Bi中(n-1)d和(n-2)f电子的存在,使得本族元素从上到下原子(或离子)半径增大趋势较小,电子受核场引力较大,失去s2电子的难度较强,即电离能I4、I5偏大。同理,IVA族、IIIA族元素失去ns2电子的电离能(分别为I3、I4和I2、I3)也应偏大。由于(n-2)f电子的填充使Ga、Ge的电离能还高出同族上一种元素。同理,由于(n-2)f电子的填充,使得Tl、Pb、Bi的电离能分别高出了同族上一种元素。这一事实,进一步说明了钻穿效应或镧系收缩对该氧化态下物质的影响。(4)同族元素自上而下具有“三增”...