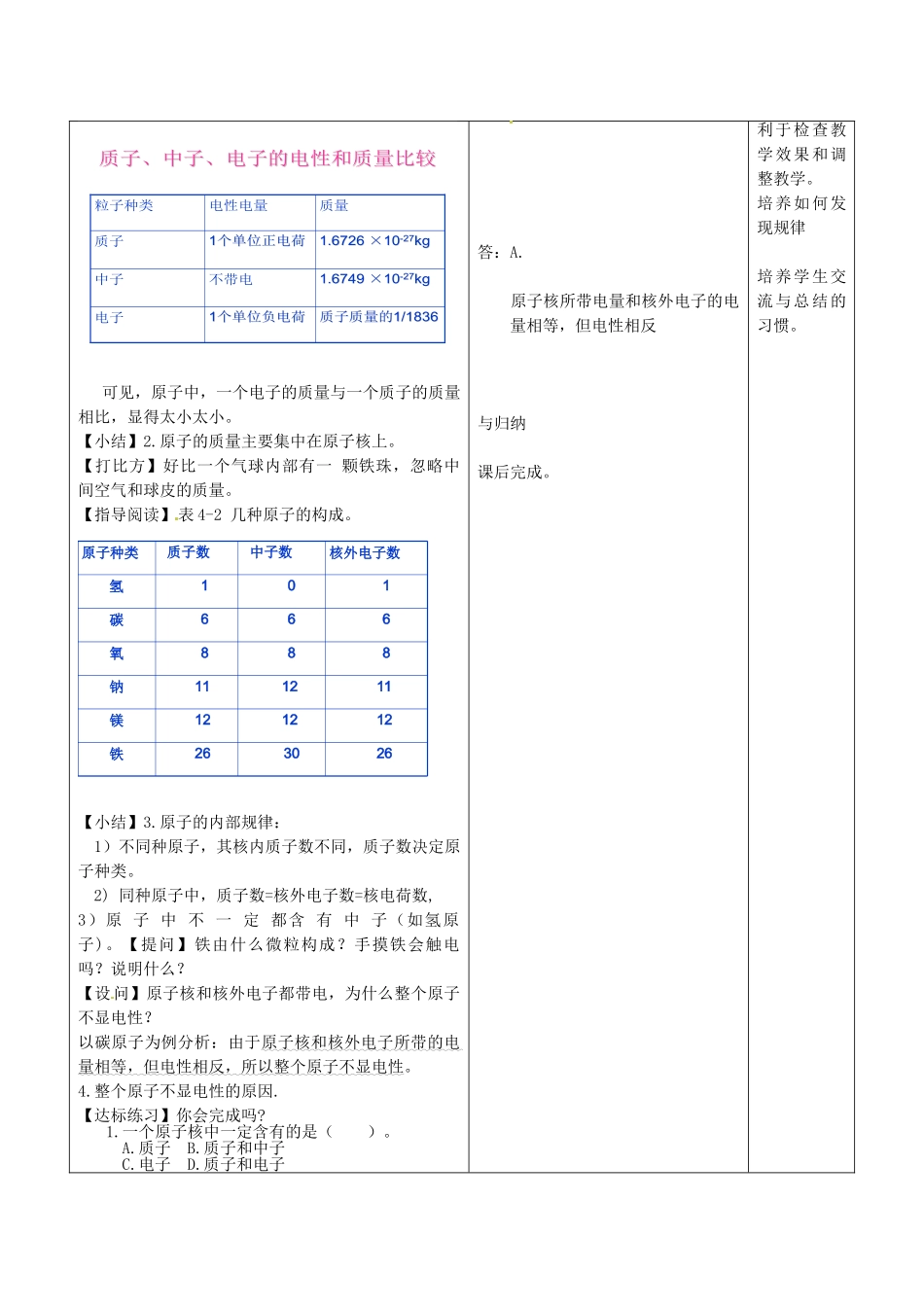
原子的结构附录:【课后作业】教学目标知识与技能1.能够说出原子的基本结构,分清原子核、核外电子、质子、中子及各自的特点;2.通过对原子构成的理解,能够对原子不显电性进行阐述,并能够应用质子数、电子数、核电荷数之间的关系解答相应的问题。过程与方法通过史料图片分析养成合作、交流习惯的同时,感受如何思考与找规律。情感态度与价值观1.培养想像与探究的学习精神,体验探究的心情,体味科学是在不断的探索中逐步发展和进步的,激发学习的兴趣与自信心。2.强化物质无限可分的辩证唯物主义的观点教学重点、难点1原子的构成2.原子中核电荷数、质子数、核外电子数的关系等规律;教学内容及问题情境景学生活动设计意图【温故引入】1.构成物质的基本微粒有哪些?2.分子是什么?原子呢?两者的区别是什么?【图片展示】英国化学家道尔顿(J.Dalton,1766~1844)近代科学原子论(1803年)1803年近代化学之父英国科学家道尔顿提出了没有人能将原子再分的论断。他说,原子是实心球体。【讲解】物质可分割成许许多多的的分子或原子等微粒,在化学变化中分子可以化分成原子,原子只是重新组合,那么原子是不是任何条件下都不可以再分了呢?(将一个人比喻成一个原子)。同样道理,原子虽小,在化学变化中不可分,但它不是一个实心球体,它跟人或其它物质一样有它自身不简单的内部结构。【资料展示】:原子图片与化学史实:回答:分子、原子、离子答:生1:分子是保持物质化学性质的最小微粒;生2:原子是在化学变化中的最小微粒。生3:在化学变化中分子可分而原子不可分。听讲、发挥想像、猜想观看并跟老师一起探讨。[来源:Z,xx,k.Com]领会。听讲、领会借助图片和史例加深理解。、由相关联的旧知识复习引入新知过渡自然。用问题引导思维,能将学生带入情境中比拟方式易被接受强化物质无限可分的观点了解人类认识原子的历史。培养学生观察立体图形能力和空间想像能力,有助于认识原子的构成。借助图片资料将抽象知识进一步形象化,科学化。养成归纳知识点的习惯碳原子的剖面图大多数α粒子直线运动少数α粒子偏转现象:极少数α粒子被弹英国科学家卢瑟福(E.Rutherford,1871~1937)1911年,英国科学家卢瑟福用一束平行高速运动的α粒子轰击金箔。【思考】原子核居于原子中心,它在原子中的体积如何?(原子里有很大的空间,电子就在这个空间做高速运动)。【小结】质子:(一个质子带一个单位的正电荷)中子:(中子不带电)电子:(一个电子带一个单位的负电荷,在原子核外作高速运动。)原子原子核1.原子结构带正电带负电一、原子的构成不显电性【观察与思考】表4-1构成原子的粒子的电性与质量学生观察、思考、讨论、听讲。思考后回答:原子核居于原子中心,比原子小得多。回顾、记录读表与思考听讲、领会、做笔记联想原子核所带电量和核外电子的电量相等,但电性相反观察、思考讨论与交流听讲、做笔记答:不会.说明铁原子没有外显电性认真听讲和做笔记培养识读图表能力。学会分析数据和比较学习的方法给学生观察思考与讨论的机会,因为学生是学习的主体。培养学生的分析、归纳能力。及时反馈与巩固新知识质子、中子、电子的电性和质量比较质子、中子、电子的电性和质量比较质子质量的质子质量的1/18361/183611个单位负电荷个单位负电荷电子1.67491.6749××1010--2727kgkg不带电中子1.67261.6726××1010--2727kgkg11个单位正电荷个单位正电荷质子质量电性电量粒子种类可见,原子中,一个电子的质量与一个质子的质量相比,显得太小太小。【小结】2.原子的质量主要集中在原子核上。【打比方】好比一个气球内部有一颗铁珠,忽略中间空气和球皮的质量。【指导阅读】表4-2几种原子的构成。原子种类质子数中子数核外电子数氢101碳666氧888钠111211镁121212铁263026【小结】3.原子的内部规律:1)不同种原子,其核内质子数不同,质子数决定原子种类。2)同种原子中,质子数=核外电子数=核电荷数,3)原子中不一定都含有中子(如氢原子)。【提问】铁由什么微粒构成?手摸铁会触电吗?说明什么?【设问】原子核和核外电子都带电,为什么整个原子不显电性?以碳原子为例分析:由于原子核和核外电...