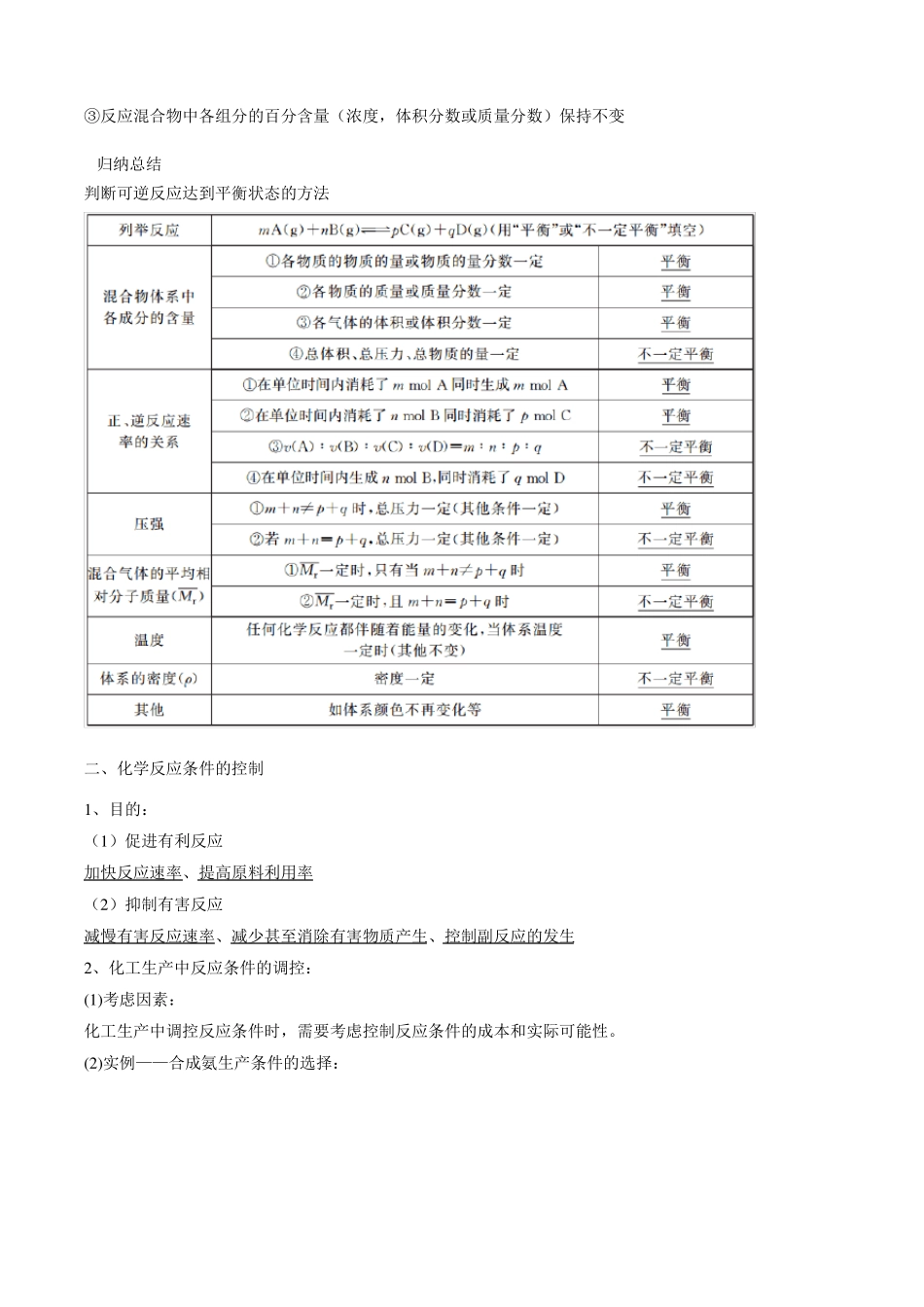
高中化学人教版(2019)必修第二册第六章第二节化学反应的速率与限度学案【学习目标】1.通过实验认识化学反应的限度、可逆反应和化学平衡的含义。2.知道当一定的外界条件改变时化学反应限度可能发生改变。3.了解控制反应条件在生产和科学研究中的作用。【基础梳理】一、化学反应的限度1、可逆反应(1)定义在同一条件下,既能向正反应方向,又能向逆反应方向进行的反应,叫做可逆反应。注意:一同两方向!(2)表示方法:书写可逆反应的化学方程式时不用“=”而用“【实验探究】实验1:氯水中含有哪些微粒?Cl2+H2O实验观察氯水的颜色试验氯水的漂白性测量pH滴加AgNO3溶液查阅资料HCl+HClO现象或性质浅黄绿色HClO具有强氧化性pH试纸变红产生白色沉淀HClO是弱酸结论有Cl2分子含有HClO分子含有H+离子含有Cl-离子含有ClO-离子”。实验2:FeCl3溶液与KI溶液反应程度的实验实验①FeCl3溶液与稍过量KI溶液反应②在反应①的溶液中加入CCl4,振荡、静现象棕黄色变深出现分层现象,结论2Fe3+2I-=2Fe++I21.有I2生成+2置③取②的上层清液,滴加KSCN溶液实验3:铜与AgNO3溶液反应程度的实验实验稍过量铜与AgNO3溶液反应现象下层为紫红色溶液变为血红色有Fe3剩余+结论Cu+2Ag+=Cu2++2Ag有Ag+剩余铜粉表面有银白色物质附着,溶液逐渐变蓝在铜器与AgNO3溶液反应后有黄色沉淀生成的清液中加KI溶液(3)特点①正反应和逆反应发生的条件相同;②反应一旦开始,在任何时刻,同时存在该反应体系中的所有反应物和生成物;而且一直在进行着正、逆反应;③不能进行到底,只能进行到一定程度——存在反应的限度。2、化学平衡(1)定义:是指在一定条件下的可逆反应里,当正反应速率和逆反应速率相等,反应物和生成物的浓度不再发生变化(反应混合物中各组分的浓度保持不变的状态)。这种状态称化学平衡状态,简称化学平衡。(2)特征:“逆”、“动”、“等”、“定”、“变”①化学平衡只存在于可逆反应中;②化学平衡是一个动态平衡;③平衡时正反应和逆反应的速率相等且大于0;④平衡时反应物和生成物的浓度保持不变;⑤改变外界条件时,使v(正)、v(逆)发生变化且v(正)≠v(逆),化学平衡就会被打破,并在新的条件下建立新的平衡。(3)判断标志对于mA(g)+nB(g)=pC(g)+qD(g)①v(正)=v(逆)②v(A消耗):v(B生成)=m:n③反应混合物中各组分的百分含量(浓度,体积分数或质量分数)保持不变归纳总结判断可逆反应达到平衡状态的方法二、化学反应条件的控制1、目的:(1)促进有利反应加快反应速率、提高原料利用率(2)抑制有害反应减慢有害反应速率、减少甚至消除有害物质产生、控制副反应的发生2、化工生产中反应条件的调控:(1)考虑因素:化工生产中调控反应条件时,需要考虑控制反应条件的成本和实际可能性。(2)实例——合成氨生产条件的选择:1.化学反应的速率(1)掌握化学反应速率的含义及表示方法。(2)了解影响化学反应速率的因素。(3)初步了解控制化学反应速率的方法。2.化学反应的限度(1)认识可逆反应及其特征。(2)了解并会判断化学平衡状态。3.化学反应条件的控制初步了解化学反应条件的控制。【思考交流】【思考与讨论1】建议设计成小组交流的形式,先请学生思考“这些反应有快有慢,快到什么程度?慢到什么程度?”提醒学生对反应快慢的描述与“时间”有关。爆炸在瞬间完成;金属生锈以年月计,因金属的性质与其存在的环境不同而差异很大;食物腐败以天计,与温度关系甚大;溶洞形成以万年计,极其缓慢。然后以教材中的图片抛砖引玉,提出问题:“你还能举出哪些涉及反应快慢的实例?”启发学生联系自己身边的反应,增强对反应快慢的感性认识。【思考与讨论2】建议课堂交流,让学生充分外显其思维。向炉膛内鼓风,用煤粉代替煤块分别是为了增大氧气浓度、增大反应物的接触面积,加快燃烧速率;把食物存放在冰箱里,糕点包装内放置除氧剂,则分别是降低温度和反应物浓度,减小反应速率;做化学实验时,研碎药品、配成溶液都是为了将反应物分散成尽可能小的粒子以增大接触面积,加快反应速率;纯氧比空气中的氧气浓度大,反应更剧烈。学生在交流的过程中,生活问题转化成了化学问题,生活经...