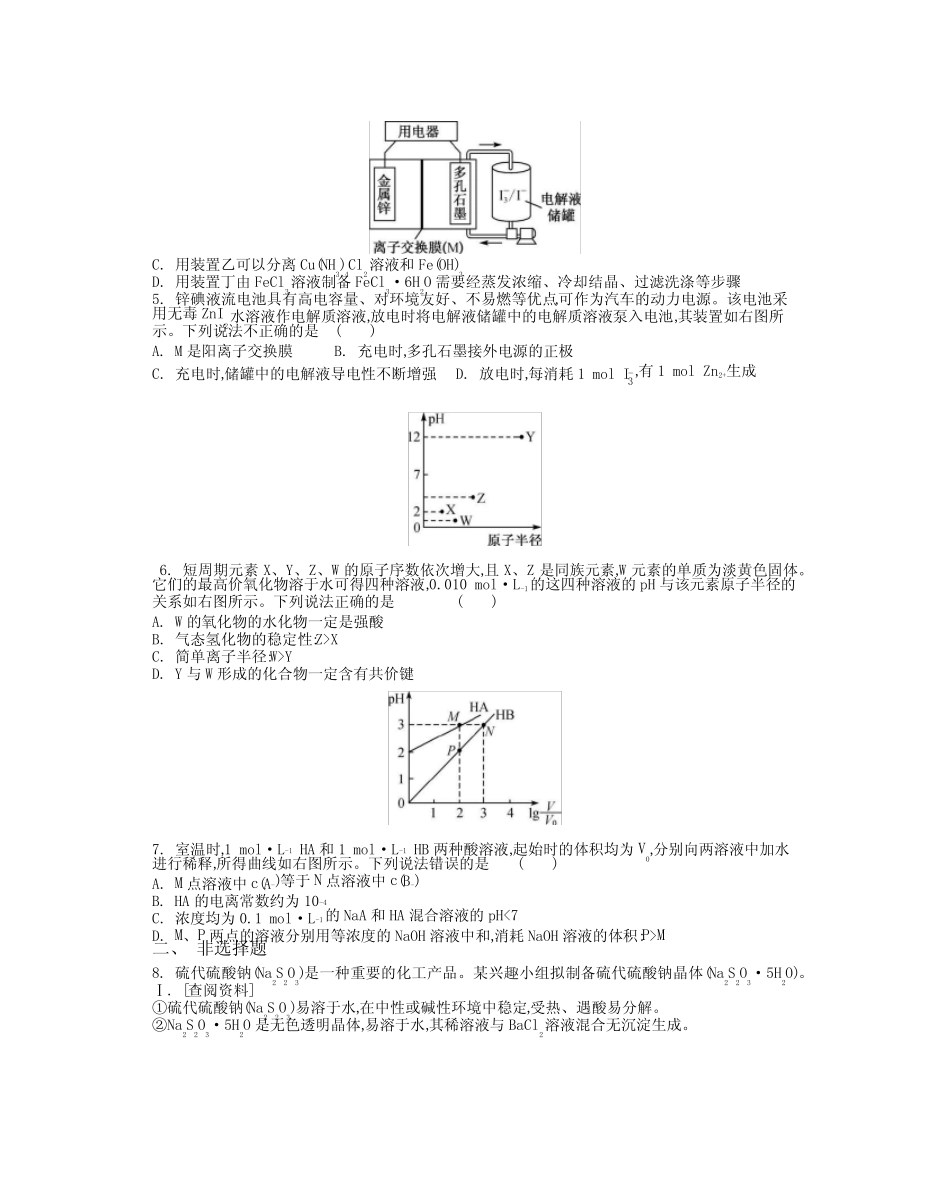
提分训练高考“7+1”提分训练1答题栏题号1234567选项班级姓名一、单项选择题1.化学在人类社会发展中发挥着重要作用,下列事实不涉及化学反应的是()A.利用废弃的秸秆生产生物质燃料乙醇B.利用石油生产塑料、化纤等高分子材料C.利用基本的化学原料生产化学合成药物D.利用反渗透膜从海水中分离出淡水2.冰晶石(Na3AlF6)微溶于水,工业上用萤石(CaF2含量为96%)、二氧化硅为原料,采用氟硅酸钠法制备冰晶石,其工艺流程如下:据此分析,下列观点不正确的是()A.滤渣A的主要成分是CaSO4B.上述流程中,所涉反应没有复分解反应C.“操作i”不可用硅酸盐质设备进行分离D.流程中可循环使用的物质除H2SO4、SiO2外,滤液B经浓缩后也能循环使用3.金刚烷是具有类似樟脑气味的无色晶体,其衍生物在医药方面有着重要的用途。以化合物X为起始原料发生一系列反应制得金刚烷(Z)的过程如下图所示,下列说法不正确的是()A.X的分子式为C10H12B.X生成Y的反应为还原反应C.Y和Z互为同分异构体D.Z和环已烷属于同系物4.利用废蚀刻液(含FeCl2、CuCl2及FeCl3)制备碱性蚀刻液[Cu(NH3)4Cl2]和FeCl3·6H2O的主要步骤:用H2O2氧化废蚀刻液、制备氨气、制备碱性蚀刻液[CuCl2+4NH3Cu(NH3)4Cl2]、固液分离、用盐酸溶解沉淀并制备FeCl3·6H2O。下列有关实验说法正确的是()甲乙丙丁A.用H2O2氧化废蚀刻液的离子方程式为2H++2Fe2++H2O22Fe3++2H2OB.用装置甲可以制备Cu(NH3)4Cl2并沉铁C.用装置乙可以分离Cu(NH3)4Cl2溶液和Fe(OH)3D.用装置丁由FeCl3溶液制备FeCl3·6H2O需要经蒸发浓缩、冷却结晶、过滤洗涤等步骤5.锌碘液流电池具有高电容量、对环境友好、不易燃等优点,可作为汽车的动力电源。该电池采用无毒ZnI2水溶液作电解质溶液,放电时将电解液储罐中的电解质溶液泵入电池,其装置如右图所示。下列说法不正确的是()A.M是阳离子交换膜B.充电时,多孔石墨接外电源的正极C.充电时,储罐中的电解液导电性不断增强D.放电时,每消耗1molI3-,有1molZn2+生成6.短周期元素X、Y、Z、W的原子序数依次增大,且X、Z是同族元素,W元素的单质为淡黄色固体。它们的最高价氧化物溶于水可得四种溶液,0.010mol·L-1的这四种溶液的pH与该元素原子半径的关系如右图所示。下列说法正确的是()A.W的氧化物的水化物一定是强酸B.气态氢化物的稳定性:Z>XC.简单离子半径:W>YD.Y与W形成的化合物一定含有共价键7.室温时,1mol·L-1HA和1mol·L-1HB两种酸溶液,起始时的体积均为V0,分别向两溶液中加水进行稀释,所得曲线如右图所示。下列说法错误的是()A.M点溶液中c(A-)等于N点溶液中c(B-)B.HA的电离常数约为10-4C.浓度均为0.1mol·L-1的NaA和HA混合溶液的pH<7D.M、P两点的溶液分别用等浓度的NaOH溶液中和,消耗NaOH溶液的体积:P>M二、非选择题8.硫代硫酸钠(Na2S2O3)是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。Ⅰ.[查阅资料]①硫代硫酸钠(Na2S2O3)易溶于水,在中性或碱性环境中稳定,受热、遇酸易分解。②Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。③向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3(2Na2S+Na2CO3+4SO23Na2S2O3+CO2),所得产品常含有少量Na2SO3和Na2SO4。Ⅱ.[制备产品]实验装置如右图。(1)实验步骤:检查装置气密性后,向三颈瓶c中加入Na2CO3和Na2S的混合溶液,再将分液漏斗a中液体滴加到烧瓶b中加热发生反应产生SO2,请写出b中发生反应的化学方程式:。待Na2S和Na2CO3完全消耗后,结束反应。过滤c中的混合物,滤液经(填操作名称)、过滤、洗涤、干燥,得到产品。(2)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是。Ⅲ.[测定产品纯度]称取10.0g产品(Na2S2O3·5H2O),配成250mL溶液,取25mL,以淀粉作指示剂,用0.1000mol·L-1碘的标准溶液滴定。反应原理为2S2O32-+I2S4O62-+2I-(忽略Na2SO3与I2反应)。(3)滴定至终点的现象为。(4)重复三次的实验数据如下表所示,其中第三次读数时滴定管中起始和终点的液面位置如下图所示,则x=,产品的纯度为。实验序号消耗0.1000mol·L-1碘的标准溶液体积/mL119.98220.023xⅣ.[探究与反思](5)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整(所需试...