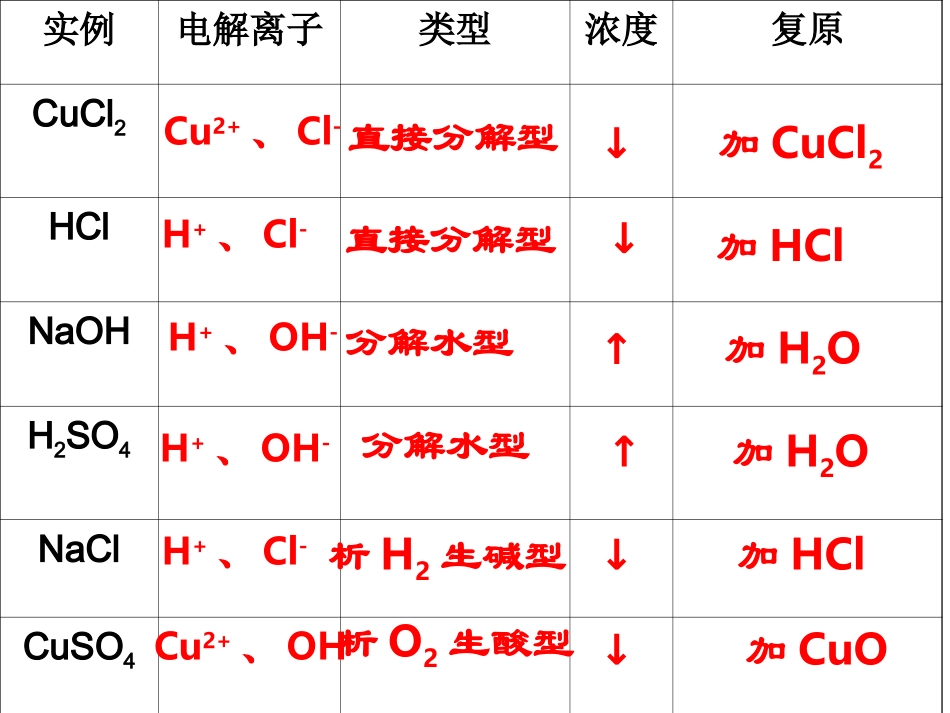
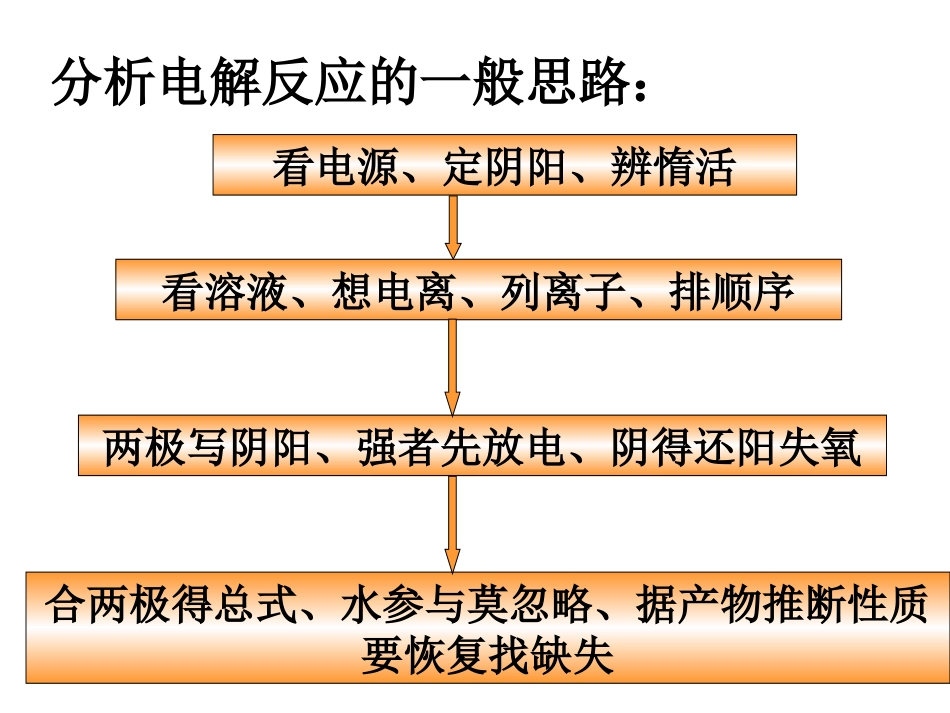
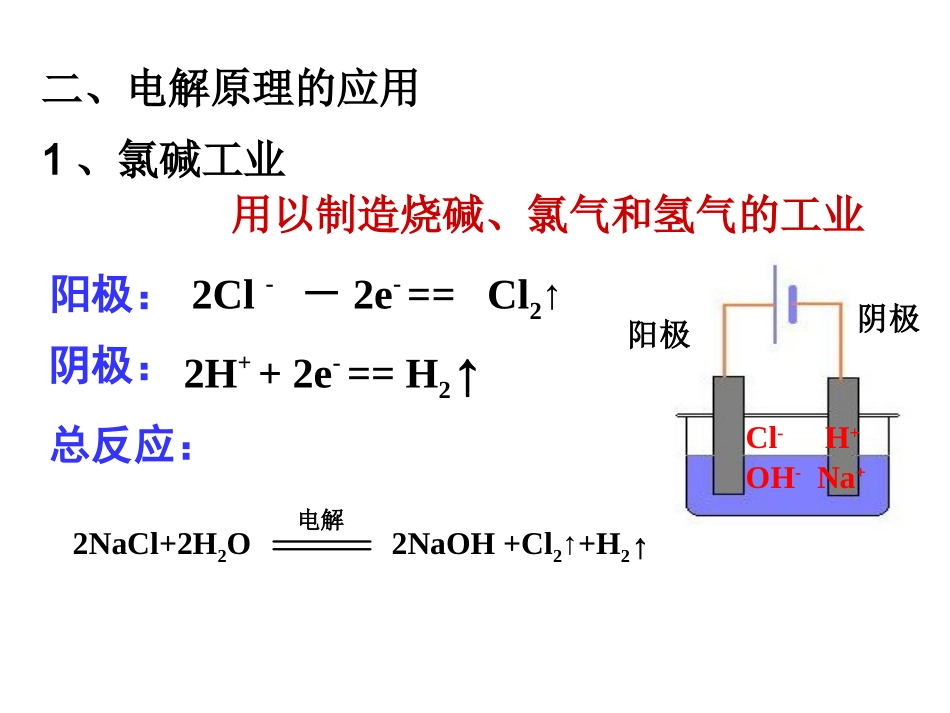
实例电解离子类型浓度复原CuCl2HClNaOHH2SO4NaClCuSO4Cu2+、Cl-H+、Cl-H+、OH-H+、OH-H+、Cl-Cu2+、OH-直接分解型直接分解型分解水型分解水型析H2生碱型析O2生酸型↓↓↑↑↓↓加CuCl2加HCl加H2O加H2O加HCl加CuO分析电解反应的一般思路:看溶液、想电离、列离子、排顺序合两极得总式、水参与莫忽略、据产物推断性质要恢复找缺失两极写阴阳、强者先放电、阴得还阳失氧看电源、定阴阳、辨惰活二、电解原理的应用1、氯碱工业阳极:2Cl--2e-==Cl2↑阴极:2H++2e-==H2↑总反应:2NaCl+2H2O2NaOH+Cl2↑+H2↑通电H+Na+Cl-OH-阴极阳极用以制造烧碱、氯气和氢气的工业电解思考:(1)电解池的两极各有什么现象?(2)怎样初步检验两极的产物?实验装置现象:阳极:有气泡产生,使淀粉-KI溶液变蓝阴极:有气泡产生,滴加酚酞溶液变红氯碱工业(2)避免生成物H2和Cl2混合,因为:___。(1)避免Cl2接触NaOH溶液会反应,使产品不纯,反应方程式:。Cl2+2NaOH=NaCl+NaClO+H2O混合遇火或遇强光爆炸解决方法:使用离子交换膜(只允许阳离子通过,不允许阴离子和气体通过)电解饱和食盐水必须解决的问题:-+Cl2Cl-H2Na+H+OH—淡盐水NaOH溶液精制饱和NaCl溶液H2O(含少量NaOH)离子交换膜阳极金属钛网阴极碳钢网阳极室阴极室氯碱工业练习1、关于电解NaCl水溶液,下列叙述正确的是()A.电解时在阳极得到氯气,在阴极得到金属钠B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性B电镀铜铜片锌片硫酸铜溶液例:电镀铜2、电镀思考1、铜做镀层金属还是做待镀金属?镀层金属思考2、在锌上镀铜,什么做阳极?什么做阴极?铜锌思考3、电解质溶液应选用什么?含有铜离子的电解质溶液思考4、电解后,硫酸铜溶液的浓度如何改变?不变电镀概念:应用电解原理在某些金属表面镀上一层其它金属或合金的过程。电镀池形成条件+镀件镀层金属-含镀层金属离子的盐溶液①镀件作阴极②镀层金属作阳极③含镀层金属阳离子的盐溶液作电解液练习2、在铁制品上镀一层锌,以下方案设计正确的()A.锌作阳极,镀件作阴极,溶液中含有锌离子B.铂作阴极,镀件为阳极,溶液中含有锌离子C.铁作阳极,镀件为阴极,溶液中含有亚铁离子D.锌作阴极,镀件作阳极,溶液中含有锌离子A+纯铜粗铜-CuSO4溶液问:电解完后,CuSO4溶液的浓度有何变化?阳极:Zn→Zn2++2e-Fe→Fe2++2e-Ni→Ni2++2e-Cu→Cu2++2e-ZnFeNiCuAgAu阴极:Cu2++2e-→Cu阳极泥阳极泥:相对不活泼的金属以单质的形式沉积在电解槽底,形成阳极泥铜的精炼制取金属钠电解熔融状态的氯化钠。通直流电后,阳极:2Cl--2e-==Cl2↑阴极:2Na++2e-==2Na总反应:2NaCl(熔融)2Na+Cl2↑通电结论:电解法是冶炼金属的一种重要方法,是最强有力的氧化还原的手段。电解制取金属铝电解熔融状态的氧化铝。阳极:6O2--12e-==3O2↑阴极:4Al3++12e-==4Al总反应:助熔剂:冰晶石(Na3AlF6六氟合铝酸钠)2Al2O3(熔融)4Al+3O2↑通电冰晶石电解