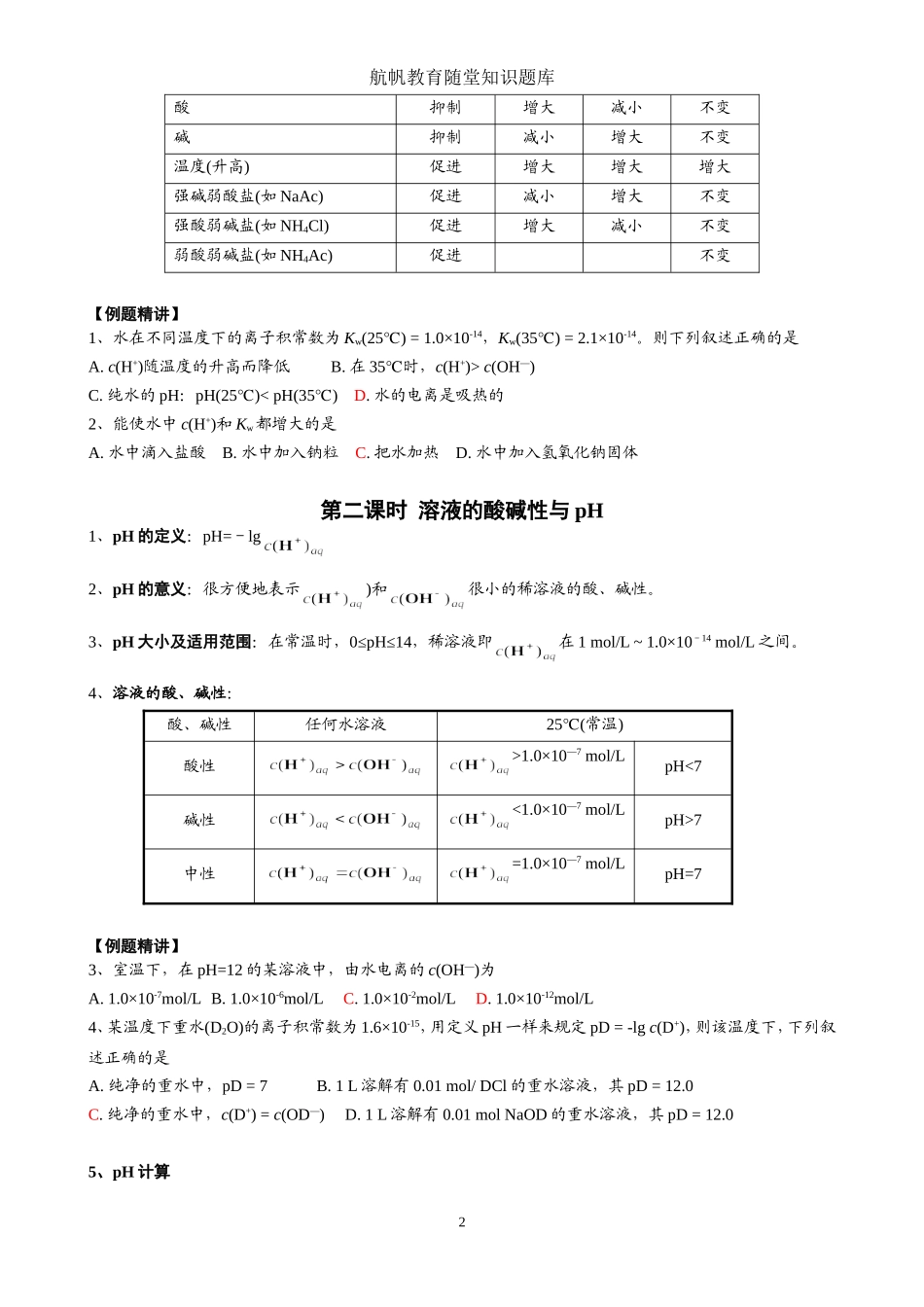
航帆教育随堂知识题库化学选修4《3-2-水的电离和溶液的酸碱性》知识方法体系与例题精讲第一课时水的电离1、水的电离的依据纯水有微弱的导电能力(精确的实验证明)2、水的电离方程式H2OH++OH—;ΔH>0或H2O+H2OH3O++OH—3、水的电离程度25℃时,纯水中4、水的电离的特点(1)吸热反应,升温电离程度增大;(2)不论是纯水还是稀溶液,(25℃时水的离子积常数);或pH+pOH=14,式中pH=-lg,pOH=-lg比如,酸溶液中:;碱溶液中:。5、水的电离的意义任何水溶液中均存在水的电离平衡,且;但。6、水的电离的影响因素(1)酸、碱:向纯水中无论是加酸还是加碱,均使水的电离平衡向左移动(抑制电离);(2)温度:升高温度,使水的电离平衡向右移动(促进电离);比如:在100℃的纯水中,,Kw=1.0×10—12。(3)易水解的盐:向纯水中加入易水解的盐(强碱弱酸盐、强酸弱碱盐、弱酸弱碱盐),均使水的电离平衡向右移动(促进电离)。影响因素水的电离结果c(H+)aqc(OH—)aqKw1航帆教育随堂知识题库酸抑制增大减小不变碱抑制减小增大不变温度(升高)促进增大增大增大强碱弱酸盐(如NaAc)促进减小增大不变强酸弱碱盐(如NH4Cl)促进增大减小不变弱酸弱碱盐(如NH4Ac)促进不变【例题精讲】1、水在不同温度下的离子积常数为Kw(25)=1.0×10℃-14,Kw(35)=2.1×10℃-14。则下列叙述正确的是A.c(H+)随温度的升高而降低B.在35℃时,c(H+)>c(OH—)C.纯水的pH:pH(25)
1.0×10—7mol/LpH<7碱性<1.0×10—7mol/LpH>7中性=1.0×10—7mol/LpH=7【例题精讲】3、室温下,在pH=12的某溶液中,由水电离的c(OH—)为A.1.0×10-7mol/LB.1.0×10-6mol/LC.1.0×10-2mol/LD.1.0×10-12mol/L4、某温度下重水(D2O)的离子积常数为1.6×10-15,用定义pH一样来规定pD=-lgc(D+),则该温度下,下列叙述正确的是A.纯净的重水中,pD=7B.1L溶解有0.01mol/DCl的重水溶液,其pD=12.0C.纯净的重水中,c(D+)=c(OD—)D.1L溶解有0.01molNaOD的重水溶液,其pD=12.05、pH计算2航帆教育随堂知识题库pH=-lgc(H+)aq,pOH=-lgc(OH-)aq,pH+pOH=14;或c(H+)aq=10-pH,c(OH-)aq=10-pOH=10pH-14(1)溶液pH的计算①酸溶液关键是c(H+),如pH=-lgc(H+),式中c(H+)=c(HCl)=c(HAc)·α,且c(HCl)<