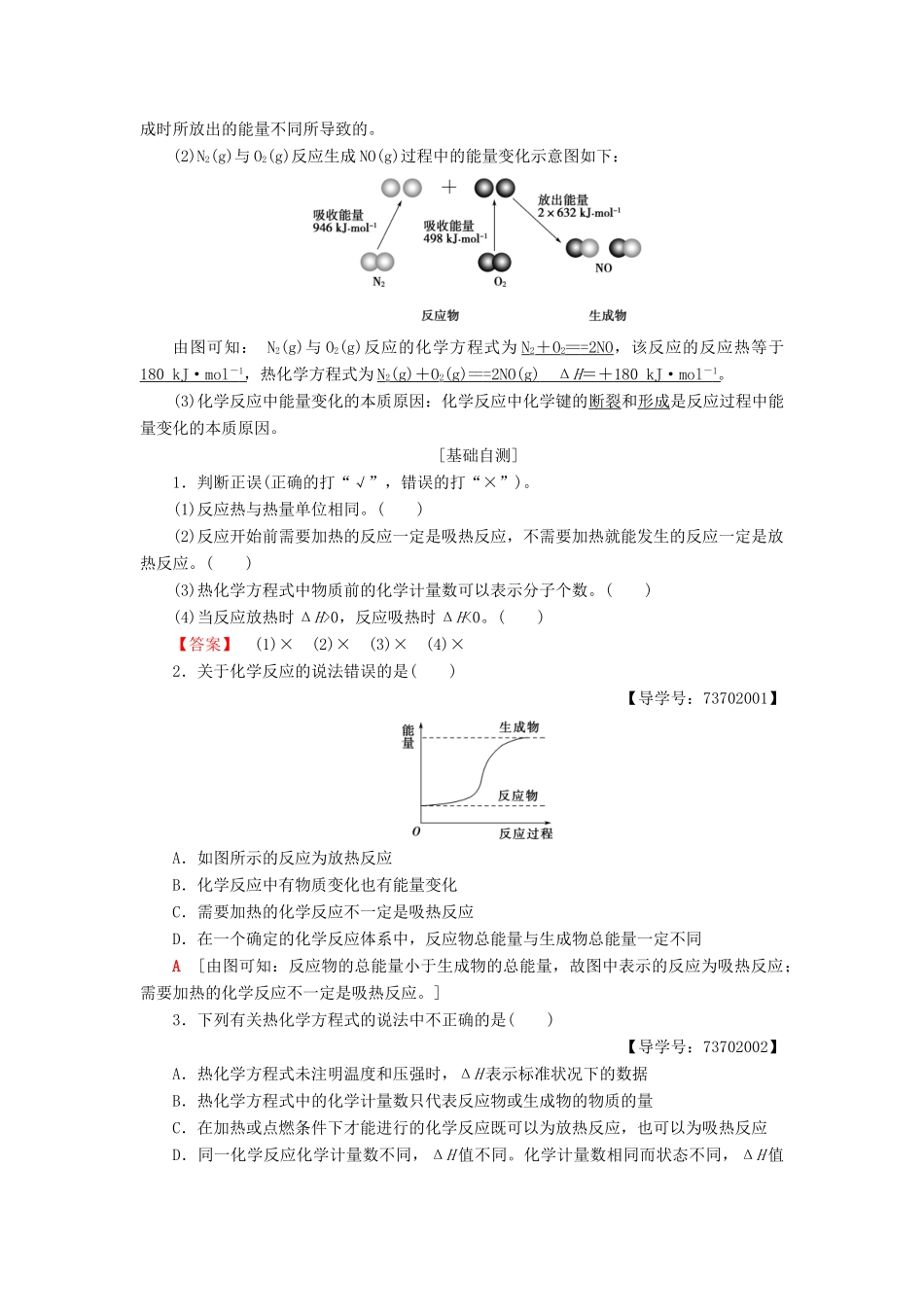
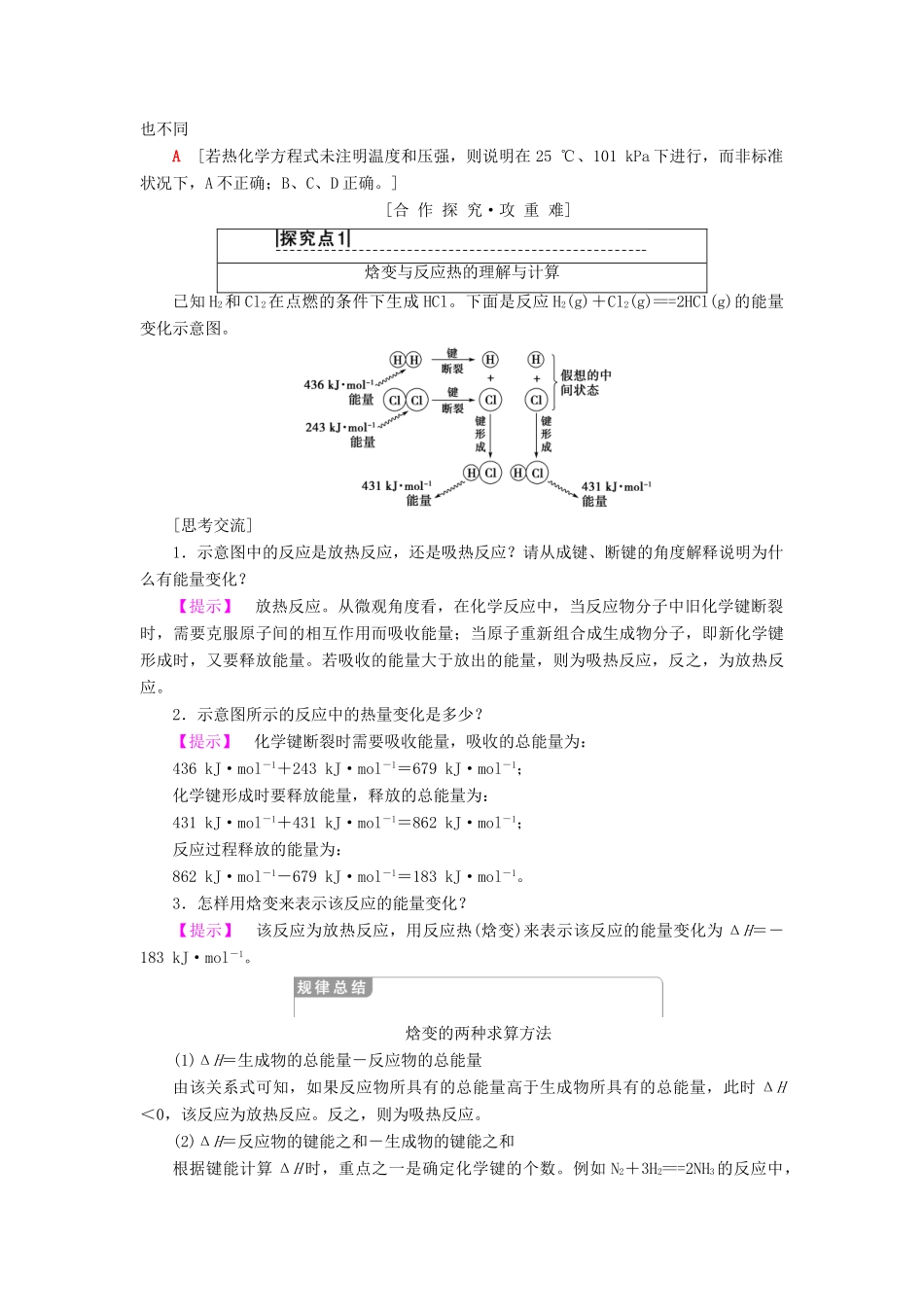
第1课时化学反应的焓变学习目标:1.通过生产、生活中的实例了解化学能与热能的相互转化。2.了解反应热和焓变的含义。了解吸热反应、放热反应的定义。(重点)3.知道键的断裂和形成是化学反应中能量变化的主要原因。(重点)4.掌握热化学方程式的意义并能正确书写热化学方程式(重点)[自主预习·探新知]1.反应热焓变(1)反应热:在化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量。(2)焓变:在恒温、恒压的条件下,化学反应过程中吸收或释放的热量,符号为ΔH,常用单位为kJ·mol-1。微点拨:(1)焓变为恒压条件下的反应热。(2)反应热、焓变的单位为kJ·mol-1,热量的单位为kJ。2.吸热反应、放热反应的定义及表示方法吸热反应放热反应定义吸收热量的反应放出热量的反应表示方法ΔH>0ΔH<0能量变化微点拨:(1)吸热反应、放热反应研究的对象为化学反应,不是物理反应。(2)反应热的大小取决于反应物总能量与生成物总能量的相对大小,与反应条件是否需要加热无关。3.热化学方程式(1)定义:能够表示反应热的化学方程式。(2)书写热化学方程式需注意的问题①书写热化学方程式时应指明反应的温度和压强,若在25℃(即298K)、101kPa时进行的反应,可不注明。②注明反应物和生成物的聚集状态。一般用“g”表示气体,“l”表示液体,“s”表示固体,“aq”表示水溶液。③在热化学方程式中,化学计量数表示物质的量,可以用整数或简单分数表示。④在热化学方程式后面注明ΔH的数值、正负号(正号可以省略)及单位(kJ·mol-1)。⑤同一化学反应,热化学方程式中物质的化学计量数不同,ΔH也不同,ΔH与化学计量数成正比关系。4.化学键与化学反应中的能量变化(1)化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时所放出的能量不同所导致的。(2)N2(g)与O2(g)反应生成NO(g)过程中的能量变化示意图如下:由图可知:N2(g)与O2(g)反应的化学方程式为N2+O2===2NO,该反应的反应热等于180kJ·mol-1,热化学方程式为N2(g)+O2(g)===2NO(g)ΔH=+180kJ·mol-1。(3)化学反应中能量变化的本质原因:化学反应中化学键的断裂和形成是反应过程中能量变化的本质原因。[基础自测]1.判断正误(正确的打“√”,错误的打“×”)。(1)反应热与热量单位相同。()(2)反应开始前需要加热的反应一定是吸热反应,不需要加热就能发生的反应一定是放热反应。()(3)热化学方程式中物质前的化学计量数可以表示分子个数。()(4)当反应放热时ΔH>0,反应吸热时ΔH<0。()【答案】(1)×(2)×(3)×(4)×2.关于化学反应的说法错误的是()【导学号:73702001】A.如图所示的反应为放热反应B.化学反应中有物质变化也有能量变化C.需要加热的化学反应不一定是吸热反应D.在一个确定的化学反应体系中,反应物总能量与生成物总能量一定不同A[由图可知:反应物的总能量小于生成物的总能量,故图中表示的反应为吸热反应;需要加热的化学反应不一定是吸热反应。]3.下列有关热化学方程式的说法中不正确的是()【导学号:73702002】A.热化学方程式未注明温度和压强时,ΔH表示标准状况下的数据B.热化学方程式中的化学计量数只代表反应物或生成物的物质的量C.在加热或点燃条件下才能进行的化学反应既可以为放热反应,也可以为吸热反应D.同一化学反应化学计量数不同,ΔH值不同。化学计量数相同而状态不同,ΔH值也不同A[若热化学方程式未注明温度和压强,则说明在25℃、101kPa下进行,而非标准状况下,A不正确;B、C、D正确。][合作探究·攻重难]焓变与反应热的理解与计算已知H2和Cl2在点燃的条件下生成HCl。下面是反应H2(g)+Cl2(g)===2HCl(g)的能量变化示意图。[思考交流]1.示意图中的反应是放热反应,还是吸热反应?请从成键、断键的角度解释说明为什么有能量变化?【提示】放热反应。从微观角度看,在化学反应中,当反应物分子中旧化学键断裂时,需要克服原子间的相互作用而吸收能量;当原子重新组合成生成物分子,即新化学键形成时,又要释放能量。若吸收的能量大于放出的能量,则为吸热反应,反之,为放热反应。2.示意图所示的反应中的热量变化是多少?【提示】化学键断裂时需要吸...