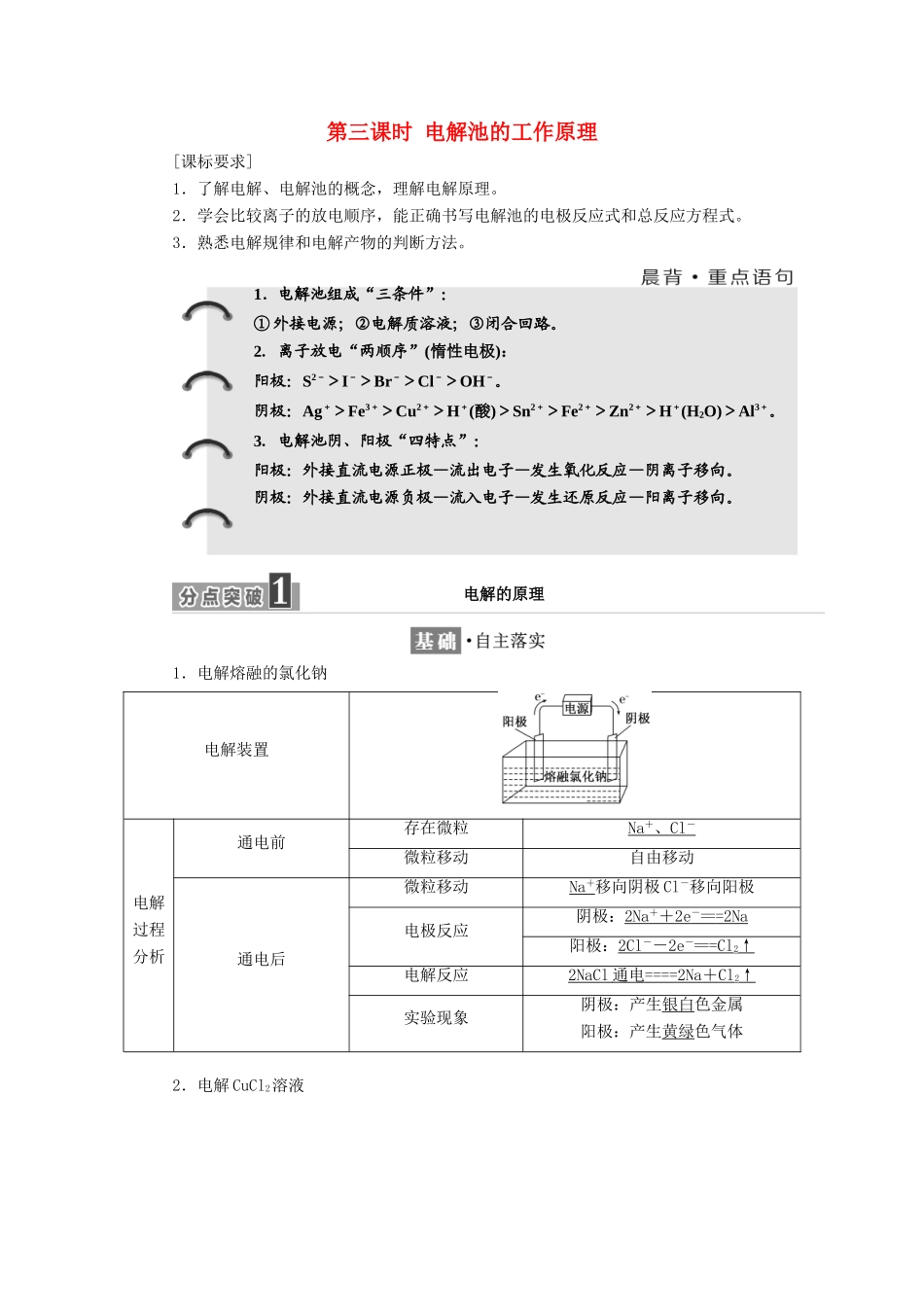
第三课时电解池的工作原理[课标要求]1.了解电解、电解池的概念,理解电解原理。2.学会比较离子的放电顺序,能正确书写电解池的电极反应式和总反应方程式。3.熟悉电解规律和电解产物的判断方法。1.电解熔融的氯化钠电解装置电解过程分析通电前存在微粒Na+、Cl-微粒移动自由移动通电后微粒移动Na+移向阴极Cl-移向阳极电极反应阴极:2Na++2e-===2Na阳极:2Cl--2e-===Cl2↑电解反应2NaCl通电====2Na+Cl2↑实验现象阴极:产生银白色金属阳极:产生黄绿色气体2.电解CuCl2溶液1.电解池组成“三条件”:①外接电源;②电解质溶液;③闭合回路。2.离子放电“两顺序”(惰性电极):阳极:S2->I->Br->Cl->OH-。阴极:Ag+>Fe3+>Cu2+>H+(酸)>Sn2+>Fe2+>Zn2+>H+(H2O)>Al3+。3.电解池阴、阳极“四特点”:阳极:外接直流电源正极—流出电子—发生氧化反应—阴离子移向。阴极:外接直流电源负极—流入电子—发生还原反应—阳离子移向。电解的原理电解装置电解过程分析通电前存在微粒Cu2+、Cl-、H+、OH-微粒运动自由移动通电后微粒运动Cu2+、H+移向阴极Cl-、OH-移向阳极电极反应阴极:Cu2++2e-===Cu阳极:2Cl--2e-===Cl2↑电解反应CuCl2====Cu+Cl2↑实验现象阴极:覆盖一层红色固体阳极:①有气泡放出;②闻到刺激性的气味;③湿润的淀粉碘化钾试纸变为蓝色3.电解的概念在直流电的作用下,在两电极上分别发生氧化反应和还原反应的过程。4.电解池(1)概念:将电能转化为化学能的装置。(2)构成条件①两个电极:阳极——与电源正极连接;阴极——与电源负极连接。②电解质溶液或熔融电解质。③直流电源。④构成闭合回路。(3)工作原理①电极反应类型。阳极→氧化反应;阴极→还原反应。②电子流向:电源负极→阴极;阳极→电源正极。③电流方向:电源正极→阳极;阴极→电源负极。④离子流向:阳离子→阴极;阴离子→阳极。1.阴、阳离子在电解过程中的移动方向与在原电池中的移动方向有什么区别和联系?提示:原电池中,阳离子移向正极,阴离子移向负极;电解池中,阳离子移向阴极,阴离子移向阳极。即阳离子都是移向发生还原反应的电极,阴离子都是移向发生氧化反应的电极。2.在氯化铜溶液中除了Cu2+和Cl-之外还有H+和OH-,这两种离子为什么没有得到或失去电子?提示:电解时,溶液中离子的放电先后顺序与离子的氧化性或还原性有关,氧化性强的阳离子先得电子被还原,还原性强的阴离子先失电子被氧化。Cu2+比H+更容易得电子,而Cl-比OH-更容易失电子,可从氧化性强弱的角度比较得电子的顺序,从还原性强弱的角度比较失电子的顺序。1.电解池电极的判断2.电解池的工作原理接通外界电源后,电子从电源的负极沿导线流入电解池的阴极,经过阴、阳离子的定向运动形成内电路,再从电解池的阳极流出,并沿导线流回电源的正极,如图所示。3.电解产物的判断(1)先判断电极类型,惰性电极是指石墨、Au、Pt等电极,除Au、Pt以外的金属电极是活性电极。(2)阳极产物的判断:首先看电极,如果是活性电极,则电极材料失去电子,被溶解;如果是惰性电极,根据阴离子的放电顺序判断。阴离子的放电顺序:S2->I->Br->Cl->OH->含氧酸根>F-。(3)阴极产物的判断:直接根据阳离子放电顺序判断。阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+。1.如图所示是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关判断正确的是()A.a为正极、b为负极B.a为阳极、b为阴极C.电解过程中,d电极质量增加D.电解过程中,氯离子浓度不变解析:选AC电流从电源的正极流出,因此a为电源正极,b为负极,则c为阳极,d为阴极;电解CuCl2溶液电极反应为阳极(c电极)2Cl--2e-===Cl2↑,阴极(d电极)Cu2++2e-===Cu,故A、C两项正确。2.写出用惰性电极电解下列溶液的电极反应式和电解反应式:(1)电解NaCl溶液:阳极:___________________________________________________________;阴极:______________________________________________________________;电解反应式:______________________________...