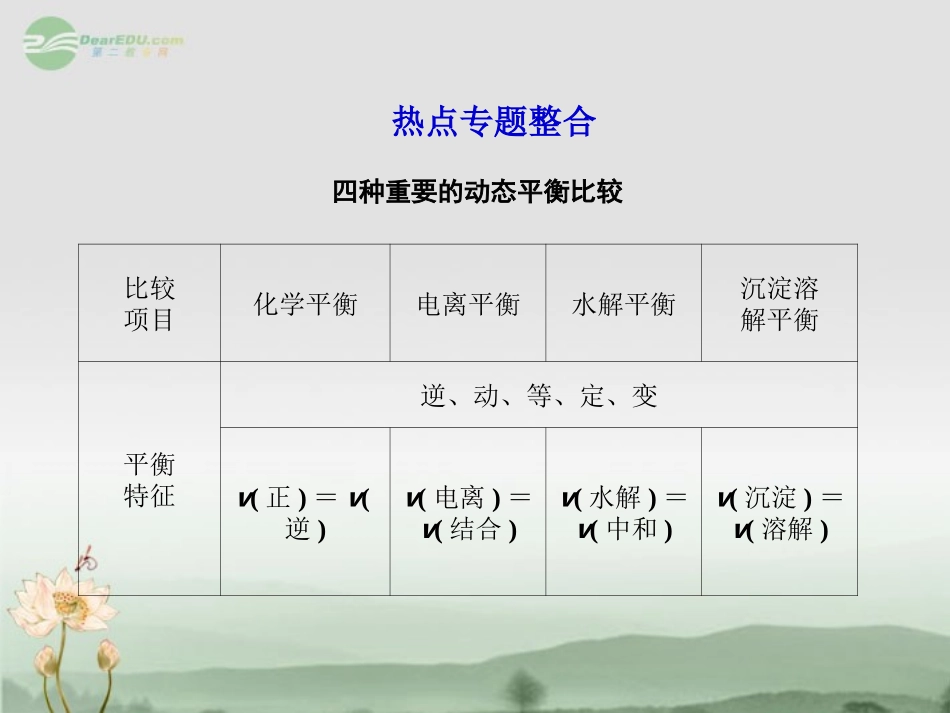
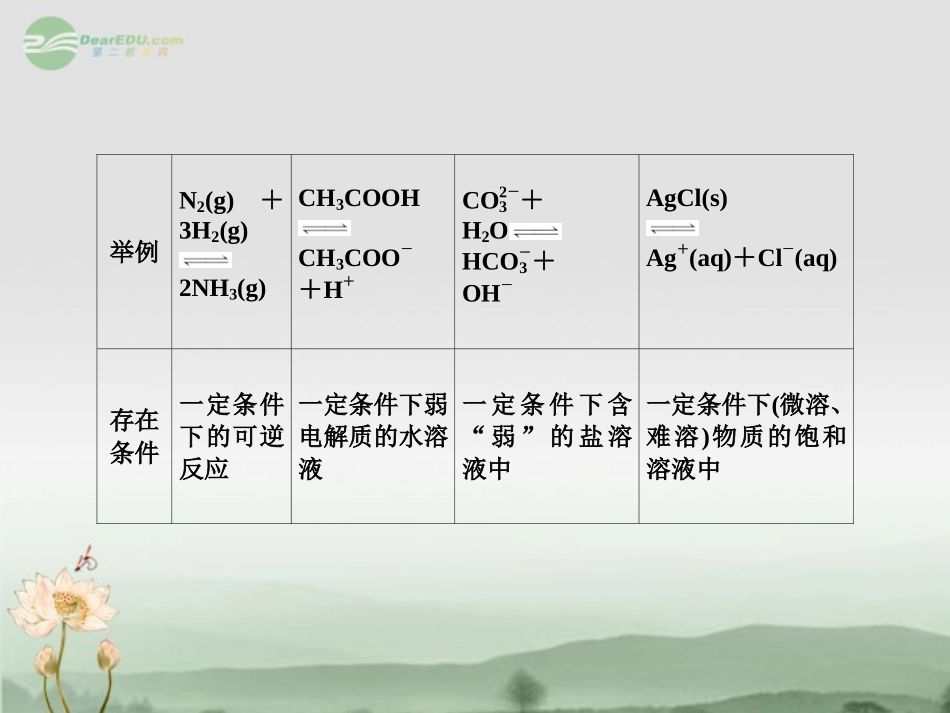
热点专题整合四种重要的动态平衡比较比较项目化学平衡电离平衡水解平衡沉淀溶解平衡平衡特征逆、动、等、定、变v(正)=v(逆)v(电离)=v(结合)v(水解)=v(中和)v(沉淀)=v(溶解)举例N2(g)+3H2(g)2NH3(g)CH3COOHCH3COO-+H+CO2-3+H2OHCO-3+OH-AgCl(s)Ag+(aq)+Cl-(aq)存在条件一定条件下的可逆反应一定条件下弱电解质的水溶液一定条件下含“弱”的盐溶液中一定条件下(微溶、难溶)物质的饱和溶液中影响因素①温度;②浓度;③压强①温度;②浓度;③同离子酸、碱、盐和化学反应①温度;②浓度;③外加电解质和化学反应①温度;②浓度;③酸、碱、盐平衡限度标准K、Ka(Kb)、KW、Ksp影响因素温度平衡移动的判据勒夏特列原理(向减弱条件改变的方向移动)(2012·珠海北大附中检测)A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:①将1LpH=3的A溶液分别与0.001mol·L-1xLB溶液、0.001mol·L-1yLD溶液充分反应至中性,x、y大小关系为:yA②开始反应时的速率A>E③参加反应的锌粉物质的量A=E④反应过程的平均速率E>A⑤A溶液里有锌粉剩余⑥E溶液里有锌粉剩余(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中的________曲线(填写序号)。(5)室温下,向0.01mol·L-1C溶液中滴加0.01mol·L-1D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为________。【精讲精析】(1)从①可知,A为酸性溶液,则B与D只能为碱性溶液,可能为NaOH、NH3·H2O,当反应达中性后,消耗B溶液的量超过了D溶液,显然这是由于B与酸生成的盐因水解而呈酸性,需要加入稍多一些的B,即B为NH3·H2O,D为NaOH;(2)由于cNH3·H2OcOH-=cNH3·H2OVcOH-V=nNH3·H2OnOH-,而稀释氨水时,氨水的电离程度增大,则n(NH3·H2O)将会减小,n(OH-)增大,即①减小、④增大;稀释时,溶液的碱性减小,即c(OH-)减小,c(H+)增大,则②cOH-cH+减小;c(H+)与c(OH-)的乘积为Kw,属于常数,③不变;(3)由③可知,在三种呈酸性的溶液中只有NH4HSO4与NaOH等体积混合后才能使溶液因水解而呈酸性,故C为NH4HSO4,再根据②给出的同浓度A、E的pH可知,A为强酸(盐酸),E为弱酸(醋酸)。若A和E的OH-浓度相等,说明两者的pH相同,则两溶液的浓度大小为:盐酸<醋酸;起始时c(H+)大小:盐酸=醋酸。由于反应放出的氢气量相等,且最后只有一份溶液中存在锌粉,显然盐酸溶液中锌过量,⑤对、⑥错;由于醋酸溶液中c(H+)一直相对较大,则反应所需时间较短,①错、④对;开始时c(H+)相同,则开始反应速率相等,②错;氢气量相同,说明参加反应的锌粉质量相同,③对;(4)B(NH3·H2O)与C(NH4HSO4)等浓度等体积混合后溶质为(NH4)2SO4,会发生NH+4+H2ONH3·H2O+H+。则温度升高,水解程度增大,溶液的酸性增强,pH减小,④对;(5)向C(NH4HSO4)中滴加D(NaOH)到中性时,所得溶液的溶质主要是(NH4)2SO4、Na2SO4(两者物质的量相等),此外因NH+4水解,加入的NaOH溶液应稍稍过量,此时溶液中离子浓度最大的应该是c(Na+)(略大于0.005mol·L-1),其次为c(SO2-4)(等于0.005mol·L-1),第三为c(NH+4)(略小于0.005mol·L-1),c(OH-)与c(H+)相等,但均很小。【答案】(1)NaOH中和酸性物质A只有NaOH、NH3·H2O,等物质的量的A与等物质的量浓度B和D混合呈中...