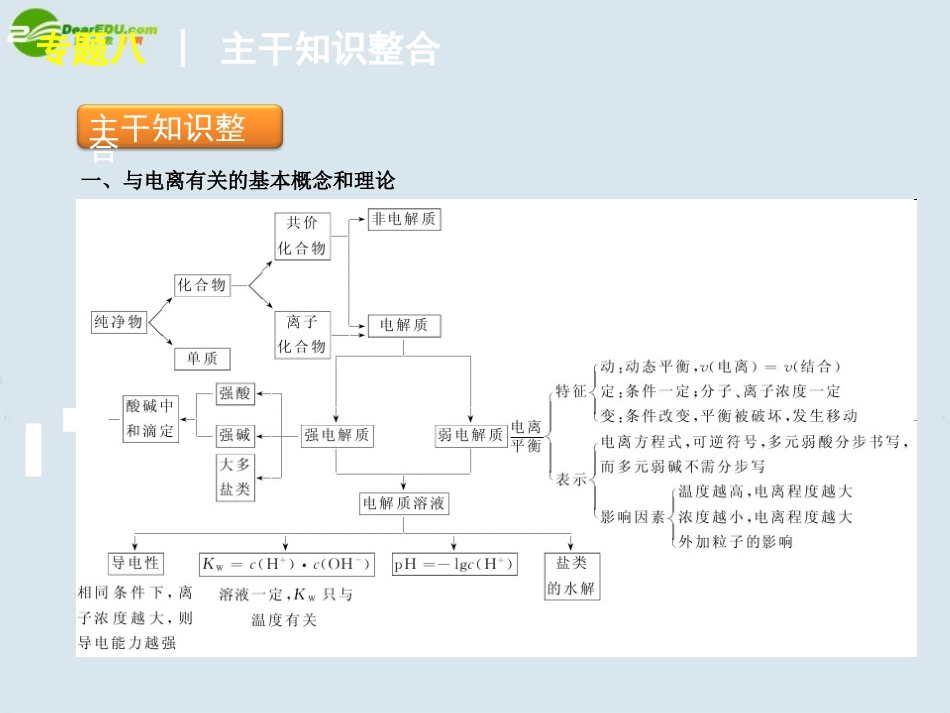
专题八│物质在水溶液中的行为专题八物质在水溶液中的行为专题八物质在水溶液中的行为主干知识整合专题八│主干知识整合一、与电离有关的基本概念和理论专题八│主干知识整合酸碱中和滴定专题八│主干知识整合操作误差分析专题八│主干知识整合专题八│主干知识整合三、沉淀溶解平衡以AgCl为例,在水中建立沉淀溶解平衡当v(溶解)=v(沉淀)时,得到饱和AgCl溶液,建立沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq)溶度积常数Ksp=c[Ag+(aq)]·c[Cl-(aq)],只与温度有关。沉淀溶解平衡的特征:逆、等、动、定、变。是一类特殊的化学平衡。专题八│主干知识整合沉淀溶解平衡的影响因素:(1)温度,(2)酸碱性,(3)离子。遵循勒夏特列原理:减少溶解平衡体系中的相应离子,平衡就向沉淀溶解的方向移动。要点热点探究专题八│要点热点探究►探究点一盐类的水解弱电解质的电离平衡一、盐类的水解1.规律:有弱才水解,无弱不水解,越弱越水解,都弱都水解,谁强显谁性,同强显中性。特点:可逆、吸热、微弱。遵循勒夏特列原理。专题八│要点热点探究2.彻底的“双水解”反应常见的含下列离子的两种盐混合时,会发生较彻底的双水解反应。需要特别注意,在书写这些物质的水解方程式时,应用“=”,并应将沉淀及气体分别用“↓”、“↑”符号标出。如:3AlO-2+Al3++6H2O=4Al(OH)3↓或3[Al(OH)4]-+Al3+===4Al(OH)3↓其他如:NH+4与AlO-2;SiO2-3与Fe3+、Al3+等离子混合。专题八│要点热点探究3.盐类水解有以下几方面的应用(1)判断盐溶液的酸碱性,或解释某些盐溶液呈酸碱性;(2)比较盐溶液中离子浓度大小或离子数多少;(3)判断盐溶液中离子种类的多少;(4)配制或贮存易水解的盐溶液;(5)制备胶体或解释某些盐有净水作用;(6)某些盐不能用蒸发方法结晶或不能用复分解反应制得;(7)判断酸碱中和至pH=7时酸碱的用量;专题八│要点热点探究(8)某些化肥不能混合施用;(9)某些活泼金属与盐溶液作用产生氢气(如Mg与NH4Cl、FeCl3溶液的反应);(10)判断离子能否大量共存;(11)某些显酸性的盐溶液和某些显碱性的盐溶液的反应。二、弱电解质的电离平衡1.弱电解质的电离平衡属于一类特殊的化学平衡,遵循勒夏特列原理。电离过程均为吸热过程。专题八│要点热点探究2.电离平衡常数CH3COOHH++CH3COO-,Ka=cH+·cCH3COO-cCH3COOHNH3·H2ONH+4+OH-,Kb=cNH+4·cOH-cNH3·H2O注意:(1)电离平衡常数只是温度的函数。(2)代入电离平衡常数公式中的浓度必须是平衡浓度。专题八│要点热点探究例1[2009·全国卷Ⅱ]现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠。按溶液pH由小到大排列正确的是()A.④①②⑤⑥③B.④①②⑥⑤③C.①④②⑥③⑤D.①④②③⑥⑤专题八│要点热点探究C【解析】①②④均属于酸,其中醋酸酸性最强,碳酸次之,苯酚最弱。③⑤⑥均属于强碱弱酸盐,根据越弱越水解的原理知,因酸性H2CO3>苯酚>HCO-3,所以对应的盐,其碱性为:碳酸钠>苯酚钠>碳酸氢钠,pH顺序相反,故C项正确。专题八│要点热点探究【高考命题者说】高考试题除了测试学生对教学内容的掌握程度,还要考查考生的学习能力,即考生运用掌握的知识,通过思考后解决实际问题的能力。本题是比较等浓度下醋酸、苯酚、碳酸3个弱酸及碳酸钠、碳酸氢钠、苯酚钠3个强碱弱酸盐溶液的pH的大小。主要是考查考生能否运用有关电解质溶液中电离平衡、溶液的pH、盐类的水解等有关知识,正确判断弱酸、弱碱和其相应盐的酸、碱性及定性地比较它们酸、碱性的大小。由于中学阶段没有介绍各种弱酸和盐类水解后溶液pH的定量计算,为解此题,需要考生调用其他的知识块,按题设情境重新归纳,统摄成规律,并运用此规律进行推理,才能对本题作出正确排序。专题八│要点热点探究首先应该知道,醋酸、碳酸、苯酚(俗称石碳酸)都是弱酸,其水溶液的pH一定小于7;而苯酚钠、碳酸钠、碳酸氢钠都是强碱弱酸盐,它们的水溶液由于弱酸根的水解而呈碱性,所以其水溶液的pH一定大于7;故排序应该是3个弱酸在前,3个弱酸盐在后。其次,比较3个弱酸的强弱。离子化合物如...