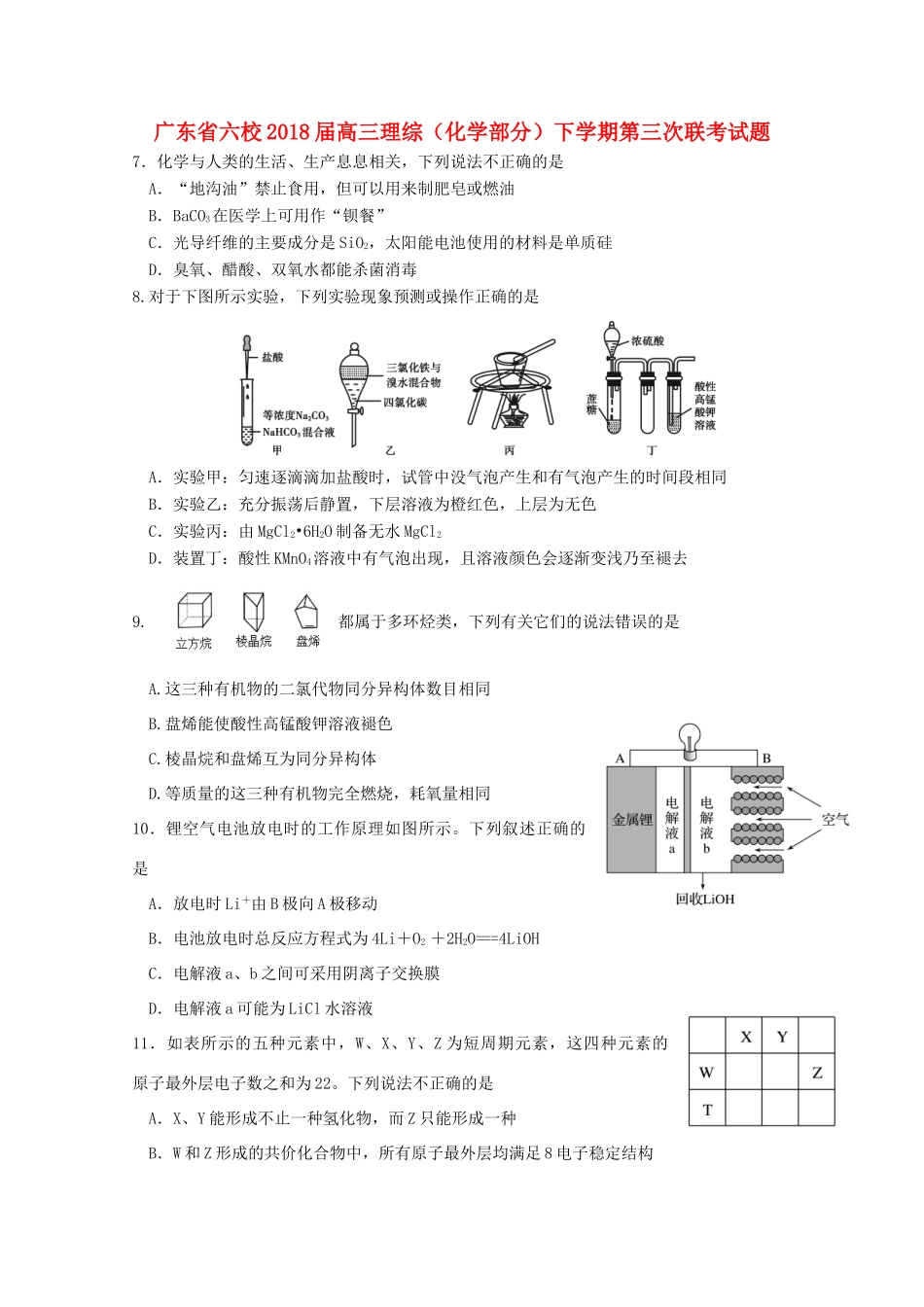
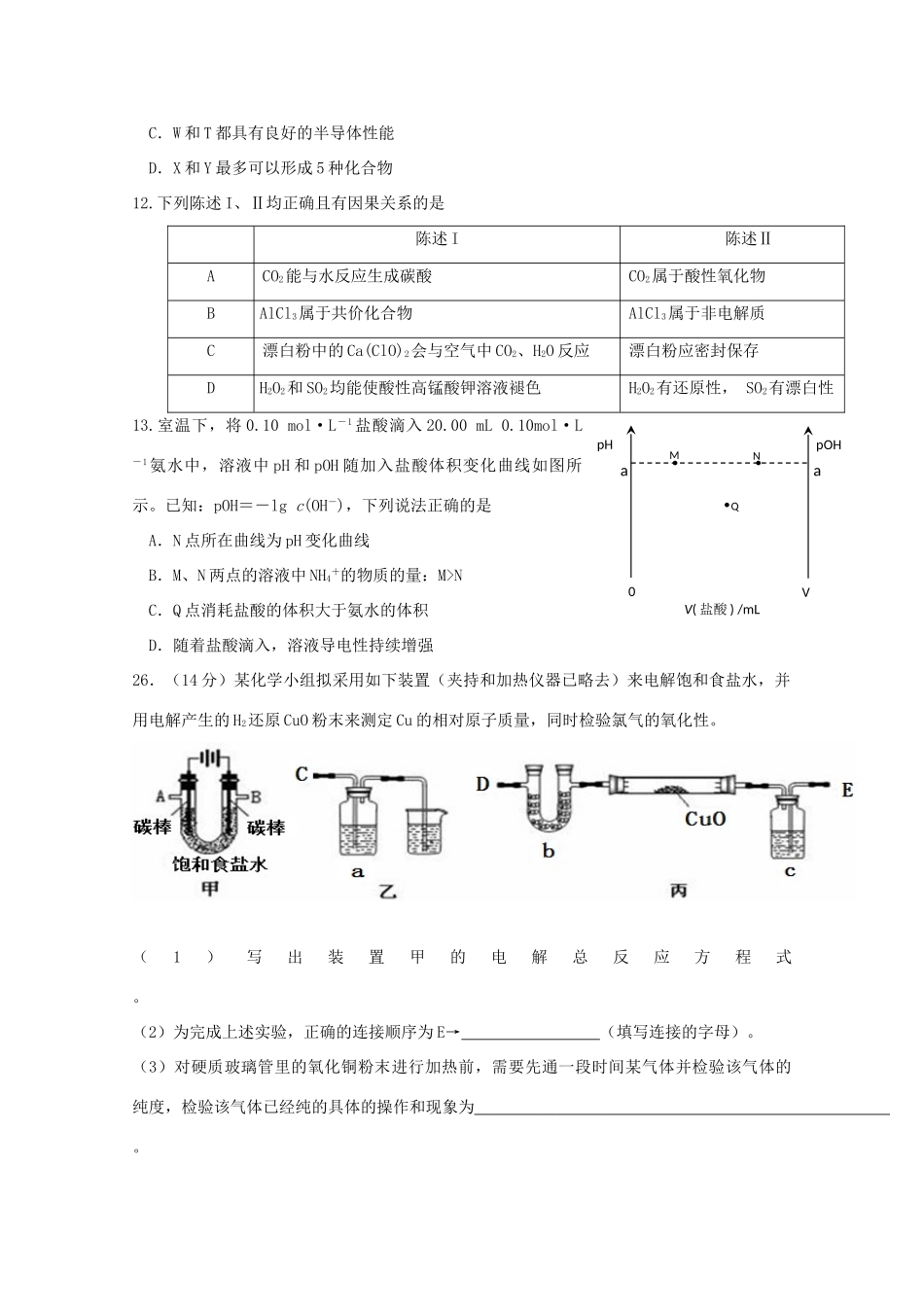
广东省六校2018届高三理综(化学部分)下学期第三次联考试题7.化学与人类的生活、生产息息相关,下列说法不正确的是A.“地沟油”禁止食用,但可以用来制肥皂或燃油B.BaCO3在医学上可用作“钡餐”C.光导纤维的主要成分是SiO2,太阳能电池使用的材料是单质硅D.臭氧、醋酸、双氧水都能杀菌消毒8.对于下图所示实验,下列实验现象预测或操作正确的是A.实验甲:匀速逐滴滴加盐酸时,试管中没气泡产生和有气泡产生的时间段相同B.实验乙:充分振荡后静置,下层溶液为橙红色,上层为无色C.实验丙:由MgCl2•6H2O制备无水MgCl2D.装置丁:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去9.都属于多环烃类,下列有关它们的说法错误的是A.这三种有机物的二氯代物同分异构体数目相同B.盘烯能使酸性高锰酸钾溶液褪色C.棱晶烷和盘烯互为同分异构体D.等质量的这三种有机物完全燃烧,耗氧量相同10.锂空气电池放电时的工作原理如图所示。下列叙述正确的是A.放电时Li+由B极向A极移动B.电池放电时总反应方程式为4Li+O2+2H2O===4LiOHC.电解液a、b之间可采用阴离子交换膜D.电解液a可能为LiCl水溶液11.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法不正确的是A.X、Y能形成不止一种氢化物,而Z只能形成一种B.W和Z形成的共价化合物中,所有原子最外层均满足8电子稳定结构C.W和T都具有良好的半导体性能D.X和Y最多可以形成5种化合物12.下列陈述I、Ⅱ均正确且有因果关系的是陈述I陈述ⅡACO2能与水反应生成碳酸CO2属于酸性氧化物BAlCl3属于共价化合物AlCl3属于非电解质C漂白粉中的Ca(ClO)2会与空气中CO2、H2O反应漂白粉应密封保存DH2O2和SO2均能使酸性高锰酸钾溶液褪色H2O2有还原性,SO2有漂白性13.室温下,将0.10mol·L-1盐酸滴入20.00mL0.10mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH=-lgc(OH-),下列说法正确的是A.N点所在曲线为pH变化曲线B.M、N两点的溶液中NH4+的物质的量:M>NC.Q点消耗盐酸的体积大于氨水的体积D.随着盐酸滴入,溶液导电性持续增强26.(14分)某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性。(1)写出装置甲的电解总反应方程式。(2)为完成上述实验,正确的连接顺序为E→(填写连接的字母)。(3)对硬质玻璃管里的氧化铜粉末进行加热前,需要先通一段时间某气体并检验该气体的纯度,检验该气体已经纯的具体的操作和现象为。V(盐酸)/mLQpHpOHMNaa0V(4)乙装置的a瓶溶液可选用。A.淀粉碘化钾溶液B.酸性高锰酸钾溶液C.硫化钠溶液D.Fe(NO3)2溶液(5)若a瓶中盛放过量的NaHSO3溶液,写出发生的离子反应方程式。(6)为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案。精确测量硬质玻璃管的质量为ag,加入CuO后,精确测量硬质玻璃管和CuO的总质量为bg,实验完毕后:甲方案:通过精确测量硬质玻璃管和Cu粉的总质量为cg,进而确定Cu的相对原子质量。乙方案:通过精确测定生成水的质量dg,进而确定Cu的相对原子质量。乙方案不足之处是。按甲方案进行计算,Cu的相对原子质量为。(用含a、b、c的式子来表示)27.(15分)锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。Ⅰ.ZnSO4溶液的制备与提纯:有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2。(1)若②中加入氧化剂为H2O2,写出离子反应方程式。(2)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤(选填①、②、③、⑤)。(3)滤渣2的主要成分为。(4)写出步骤④后产生滤渣3的离子反应方程式。(5)滤液3中含碳粒子浓度大小的顺序为。Ⅱ.BaS溶液的制备:(6)写出煅烧还原的化学反应方程式。BaSO4和BaCO3的KSP相当,解释为什么BaCO3可溶于盐酸中而BaSO4难溶。Ⅲ.制取锌钡白:(7)如果生产流程步骤⑤硫酸...