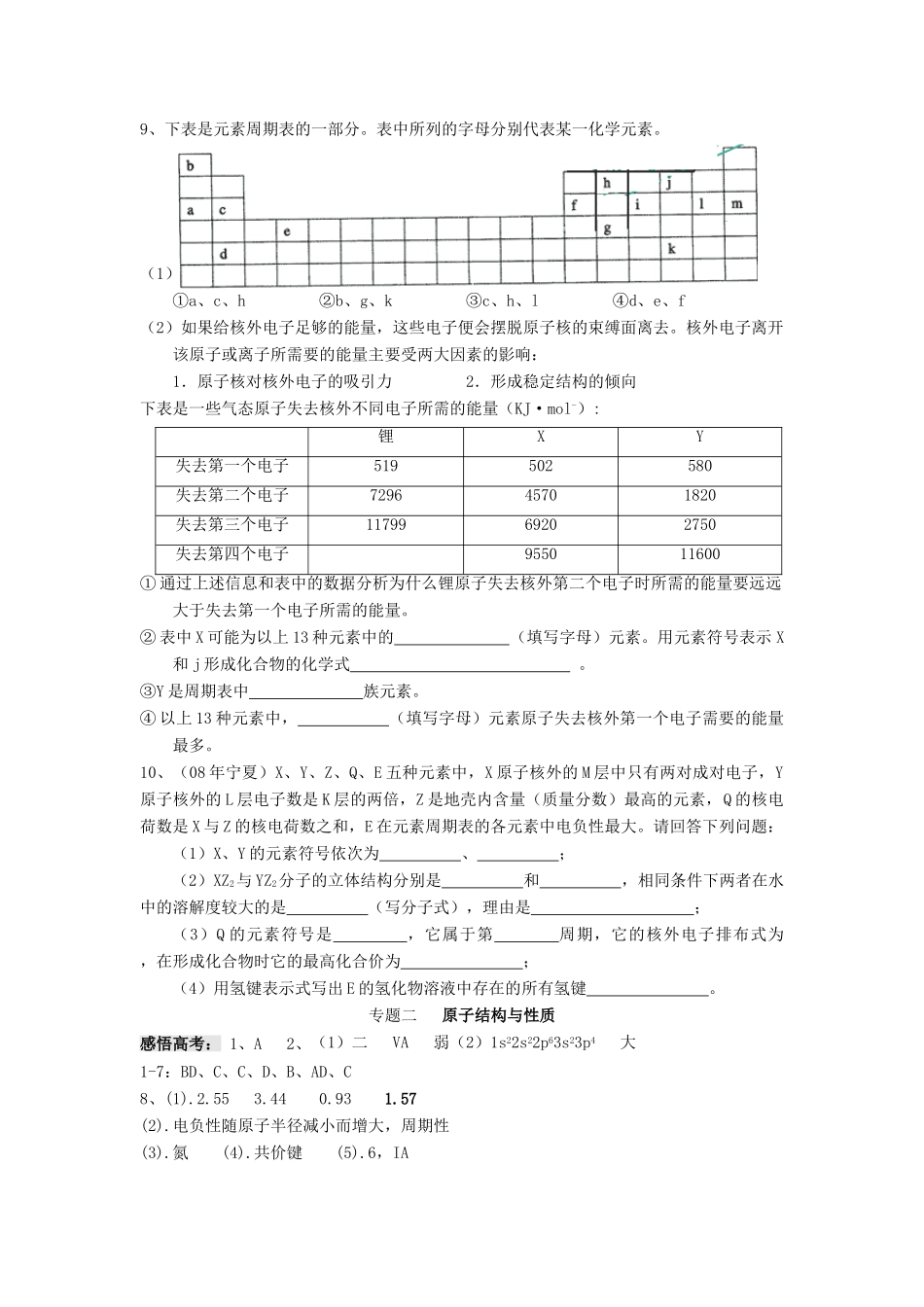
专题二原子结构与性质作业纸姓名:_________班级_________学号___________1.已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是()A、质子数c>bB、离子的还原性Y2->Z-C、氢化物的稳定性H2Y>HZD、原子半径X>W2.下列各组元素性质递变情况错误的是()ALi、Be、B原子最外层电子数依次增多BP、S、Cl元素最高正化合价依次升高CN、O、F原子半径依次增大DNa、K、Rb的金属性依次增强3.镭是元素周期表中第七周期的ⅡA族元素。下面关于镭的性质的描述中不正确的是()A在化合物中呈+2价B单质使水分解、放出氢气C氢氧化物呈两性D碳酸盐难溶于水4.对Na、Mg、Al的有关性质的叙述正确的是()A.碱性:NaOH
Mg>AlD.还原性:Na>Mg>Al5.在下面的电子结构中,第一电离能最大的原子可能是()A.ns2np3B.ns2np5C.ns2np4D.ns2np26.下列各组微粒按半径逐渐增大,还原性逐渐增强的顺序排列的是()ANa、K、RbBF、Cl、BrCMg2+、Al2+、Zn2+DCl-、Br-、I-7、已知X、Y元素同周期,且电负性X>Y,下列说法错误的是()AX与Y形成化合物是,X可以显负价,Y显正价B第一电离能可能Y小于XC最高价含氧酸的酸性:X对应的酸性弱于于Y对应的D气态氢化物的稳定性:HmY小于HmX8、1932年美国化学家鲍林首先提出了电负性的概念.电负性(用X表示)也是元素的一种重要性质,若x越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方.下面是某些短周期元素的x值:元素符号LiBeBCOFNaAlSiPSClx值0.981.572.042.553.443.980.931.611.902.192.583.16⑴.通过分析x值变化规律,确定N、Mg的x值范围:<x(N)<,<x(Mg)<.⑵.推测x值与原子半径的关系是;根据短周期元素的x值变化特点,体现了元素性质的变化规律.⑶.某有机化合物结构中含S-N键,其共用电子对偏向(写原子名称).⑷.经验规律告诉我们:当成键的两原子相应元素的x差值△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键.试推断AlBr3中化学键类型是.⑸.预测周期表中,x值最小的元素位于周期族.(放射性元素除外)9、下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。(1)下列(填写编号)组元素的单质可能都是电的良导体。①a、c、h②b、g、k③c、h、l④d、e、f(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚面离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:1.原子核对核外电子的吸引力2.形成稳定结构的倾向下表是一些气态原子失去核外不同电子所需的能量(KJ·mol-):锂XY失去第一个电子519502580失去第二个电子729645701820失去第三个电子1179969202750失去第四个电子955011600①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量。②表中X可能为以上13种元素中的(填写字母)元素。用元素符号表示X和j形成化合物的化学式。③Y是周期表中族元素。④以上13种元素中,(填写字母)元素原子失去核外第一个电子需要的能量最多。10、(08年宁夏)X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:(1)X、Y的元素符号依次为、;(2)XZ2与YZ2分子的立体结构分别是和,相同条件下两者在水中的溶解度较大的是(写分子式),理由是;(3)Q的元素符号是,它属于第周期,它的核外电子排布式为,在形成化合物时它的最高化合价为;(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键。专题二原子结构与性质感悟高考:1、A2、(1)二VA弱(2)1s22s22p63s23p4大1-7:BD、C、C、D、B、AD、C8、(1).2.553.440.931.57(2).电负性随原子半径减小而增大,周期性(3).氮(4).共价键(5).6,IA9、(1)1、4(2)已成稳定结构、a、Na2O2或Na2O、ⅢA、m10、(1)SC(2)V形直线形SO2因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大(3)Cr四1s22s22p63s23p63d54s1+6(4)F—H…FF—H…OO—H…FO—H…O