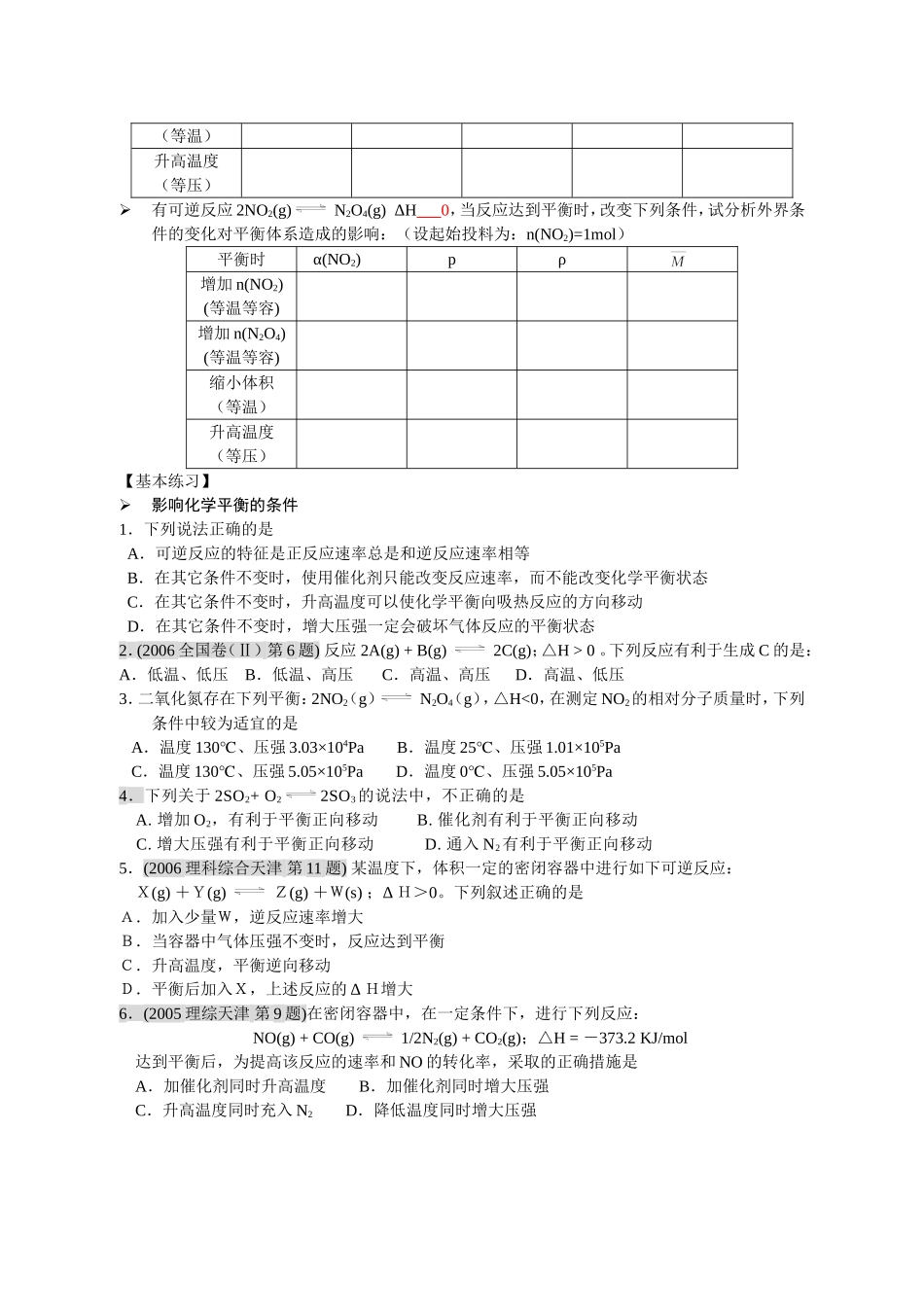
3.2 3.2 化学平衡化学平衡 (( 33 化学平衡的移动化学平衡的移动 ))【归纳与整理】1.影响化学平衡的条件(1)浓度(2)压强3)温度 (4)催化剂v 正v 逆v 平c( 反应物 )↑c( 反应物 )↓c( 生成物 )↑c( 生成物 )↓tvv 正v 逆v 平0v 正v 逆v 平p↑p↓tvv 正v 逆v 平0气体体积增大的方向气体体积减小的方向v 正v 逆v 平T↑T↓tvv 逆v 正v 平0放热反应方向吸热反应方向v 正v 逆v 平催化剂tvv 正 = v 逆 = v 平0反应特征改变条件改变条件瞬间达到新平衡前平衡移动方向V(正)V(逆)V(正) 与V(逆)关系H<0△升高温度降低温度气体化学计量数减小增大压强减小压强气体化学计量数不变增大压强减小压强改变浓度增大c(反应物)增大c(生成物)减小c(反应物)减小c(生成物)充入惰性气体恒温恒容恒温恒压气 体 化 学 计量数减小气 体 化 学 计量数不变使用催化剂勒夏特列原理〖例 1〗有下列三个体系 分别在某温度下达到平衡 CO(g) + H2O(g) CO2(g) + H2(g) -----------------------------(a)PCl5(g) PCl3(g) + Cl2(g) -------------------------------------------(b)CO(g) +Cl2(g) COCl2(g) ----------------------------------------------(c)⑴ 保持总体积和温度不变,加入一定量惰性气体,使总压力增加一倍,平衡分别如何移动? 说明理由。⑵ 保持总压力和温度不变,加入一定量惰性气体,使总体积增加一倍,平衡分别如何移动? 通过简单计算说明。2.平衡移动对平衡体系的性质的影响有可逆反应 N2(g) + 3 H2(g) 2 NH3(g) ΔH 0 ,当反应达到平衡时,改变下列条件,试分析外界条件的变化对平衡体系造成的影响:(设起始投料为:n(N2)=1mol n(H2)=3mol)平衡时α (N2)α (H2)pρ增加 n(N2)(等温等容)增加 n(H2)(等温等容)增加 n(NH3)(等温等容)缩小体积(等温)升高温度(等压)有可逆反应 2NO2(g) N2O4(g) ΔH 0,当反应达到平衡时,改变下列条件,试分析外界条件的变化对平衡体系造成的影响:(设起始投料为:n(NO2)=1mol)平衡时α(NO2)pρ增加 n(NO2)(等温等容)增加 n(N2O4)(等温等容)缩小体积(等温)升高温度(等压)【基本练习】影响化学平衡的条件1.下列说法正确的是 A.可逆反应的特征是正反应速率总是和逆反应速率相等 B.在其它条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态 C.在其它条件不变时,升高温度可以使化学...