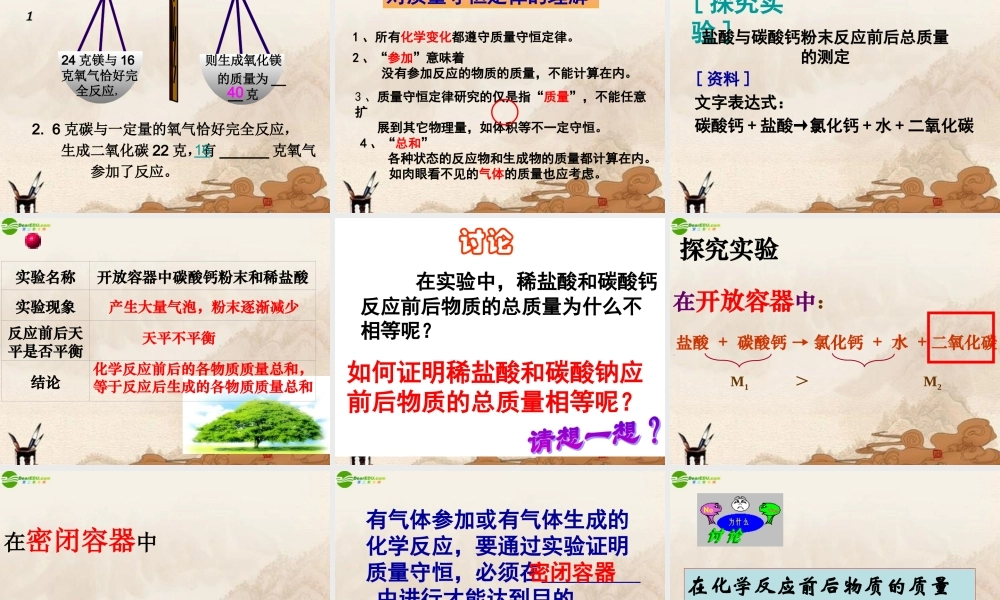
第一节第七章化学反应与化学方程式 1. 化学反应的 实质是什么? 2. 怎样判断化学反应已经 发生? 化学反应的实质: 化学反应中,分子分裂成原子, 原子重新组合成新分子。 化学变化时,一定有新物质生成,还会伴随能量的释放或吸收,有时还会发生颜色变化、或生成沉淀、产生气体等现象。质量不变质量变大质量变小实验探究活动的一般步骤提出假设实验分析得出结论设计方案进行实验硫酸铜溶液和氢氧化钠溶液反应前后总质量的测定实验一:实验二:白磷燃烧前后总质量的测定实验一:氢氧化钠溶液跟硫酸铜溶液反应前后质量的测定( 1 )称量烧杯内物质的总质量( 2 )倾斜烧杯,使二者反应。观察 产生的现象为:( 3 )称量烧杯内物质的总质量实验一:硫酸铜溶液和氢氧化钠溶液反 应前后总质量的测定实验步骤实验现象实验结论1 、称量大烧杯中硫酸铜溶液 色,小试管中氢氧化钠溶液 色,所称质量M1= g2 、混合两种 溶液生成 .3 、再次称量所称质量M2= g蓝无蓝色沉淀化学反应前后物质的质量总和没有改变实验二:白磷燃烧前后质量的测定 :( 1 )在锥形瓶中放一小块白磷( 2 )称量锥形瓶内物质的总质量( 3 )点燃白磷,观察产生的现象为: 产生大量白烟,放热( 4 )冷却后称量锥形瓶内物质的总质量,反应前和反应后物质的总质量有没有变化 ? 实验 1 :实验名称白磷在空气中燃烧实验现象反应前后天平是否平衡结论化学反应前的各物质质量总和,等于反应后生成的各物质质量总和白磷燃烧产生大量白烟,放出热量天平平衡实验小结 磷 + 氧气 点燃 五氧化二磷 MM11 = M = M22 硫酸铜 + 氢氧化钠 → 氢氧化铜 + 硫酸钠 M1 = M2•无数实验证明: 参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。这个规律叫做质量守恒定律。练习:则生成氧化镁 的质量为 ____ 克24 克镁与 16克氧气恰好完全反应,40 2. 6 克碳与一定量的氧气恰好完全反应, 生成二氧化碳 22 克,有 ______ 克氧气 参加了反应。1611对质量守恒定律的理解4 、“总和” 各种状态的反应物和生成物的质量都计算在内。 如肉眼看不见的气体的质量也应考虑。2 、“参加”意味着 没有参加反应的物质的质量,不能计算在内。1 、所有化学变化都遵守质量守恒定律。3 、质量守恒定律研究的仅是指“质量”,不能任意扩 展到其它物理量,如体积等不一定守恒。 文字表达式:碳酸钙 + 盐酸→氯化钙 ...