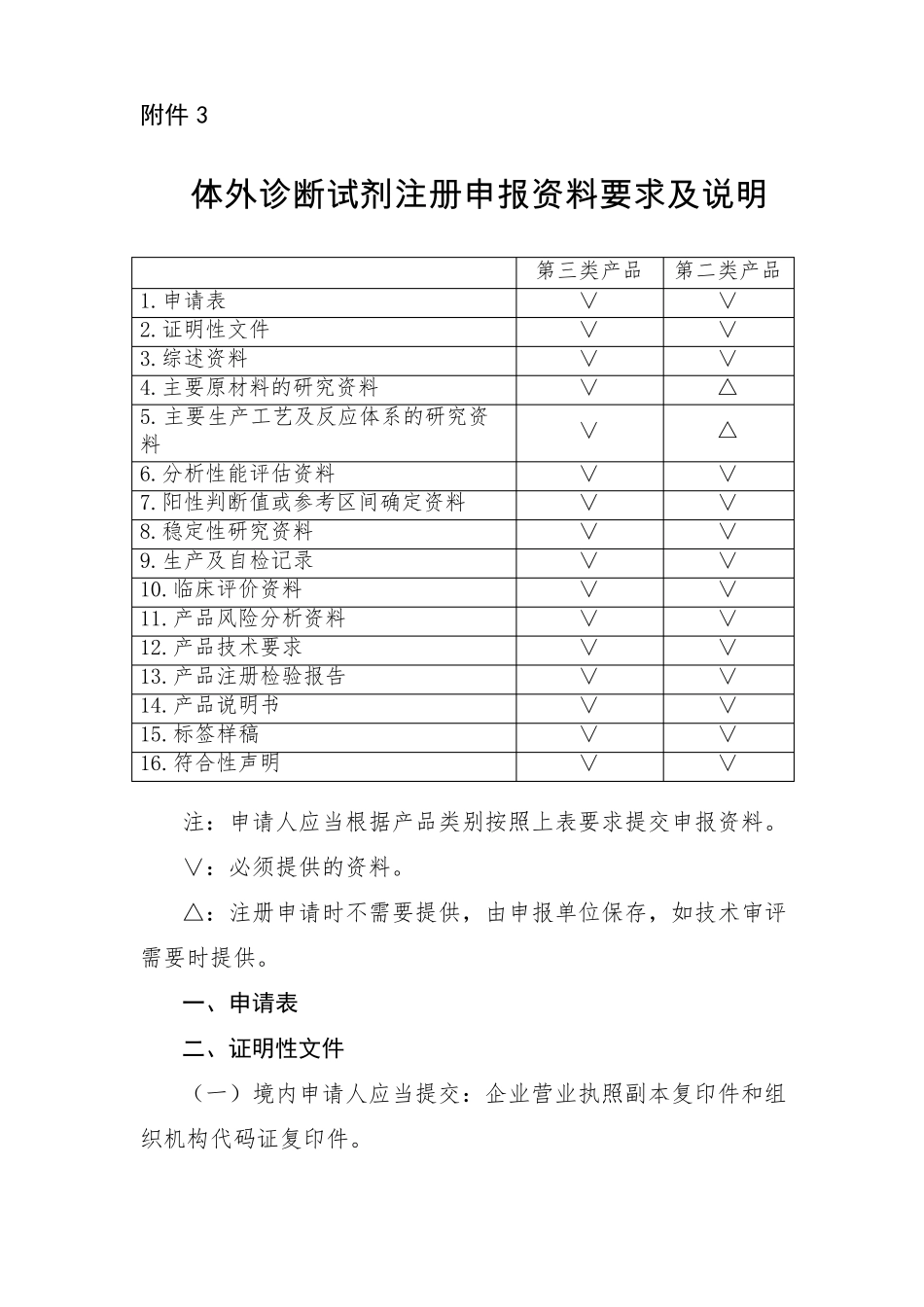
附件 3体外诊断试剂注册申报资料要求及说明1.申请表2.证明性文件3.综述资料4.主要原材料的研究资料5.主要生产工艺及反应体系的研究资料6.分析性能评估资料7.阳性判断值或参考区间确定资料8.稳定性研究资料9.生产及自检记录10.临床评价资料11.产品风险分析资料12.产品技术要求13.产品注册检验报告14.产品说明书15.标签样稿16.符合性声明第三类产品第二类产品∨∨∨∨∨∨∨△∨∨∨∨∨∨∨∨∨∨∨∨△∨∨∨∨∨∨∨∨∨∨∨注:申请人应当根据产品类别按照上表要求提交申报资料。∨:必须提供的资料。△:注册申请时不需要提供,由申报单位保存,如技术审评需要时提供。一、申请表二、证明性文件(一)境内申请人应当提交:企业营业执照副本复印件和组织机构代码证复印件。(二)境外申请人应提交:1.申请人注册地或者生产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件和可以合法生产申报产品的资格证明文件,如该证明文件中有产品类别描述,其类别应当覆盖申报产品。2.申请人注册地或者生产地址所在国家(地区)未将该产品作为医疗器械管理的,申请人需要提供相关证明文件,包括注册地或者生产地址所在国家(地区)准许该产品上市销售的证明文件。3.申请人符合注 册地或者生产地址所在国家(地区)医疗器械质量管理体系要求或者通过其他质量管理体系认证的证明文件。4.申请人在中国境内指定代理人的委托书、代理人承诺书及营业执照副本复印件或者机构登记证明副本复印件。三、综述资料(一)产品预期用途。描述产品的预期用途,与预期用途相关的临床适应症背景情况,如临床适应症的发生率、易感人群等,相关的临床或实验室诊断方法等。(二)产品描述。描述产品所采用的技术原理,主要原材料的来源及制备方法,主要生产工艺过程,质控品、校准品的制备方法及溯源(定值)情况。(三)有关生物安全性方面说明。由于体外诊断试剂中的主要原材料可能是由各种动物、病原体、人源的组织和体液等生物材料经处理或者添加某些物质制备而成,人源性材料须对有关传染病(HIV、HBV、HCV 等)病原体检测予以说明,并提供相关的证明文件。其他动物源及微生物来源的材料,应当提供相应的说明文件,证明其在产品运输、使用过程中对使用者和环境是安全的,并对上述原材料所采用的灭活等试验方法予以说明。(四)有关产品主要研究结果的总结和评价。(五)其他。包括同类产品在国内外批准上市的情况。相关产品所采用的技术方法及临床...