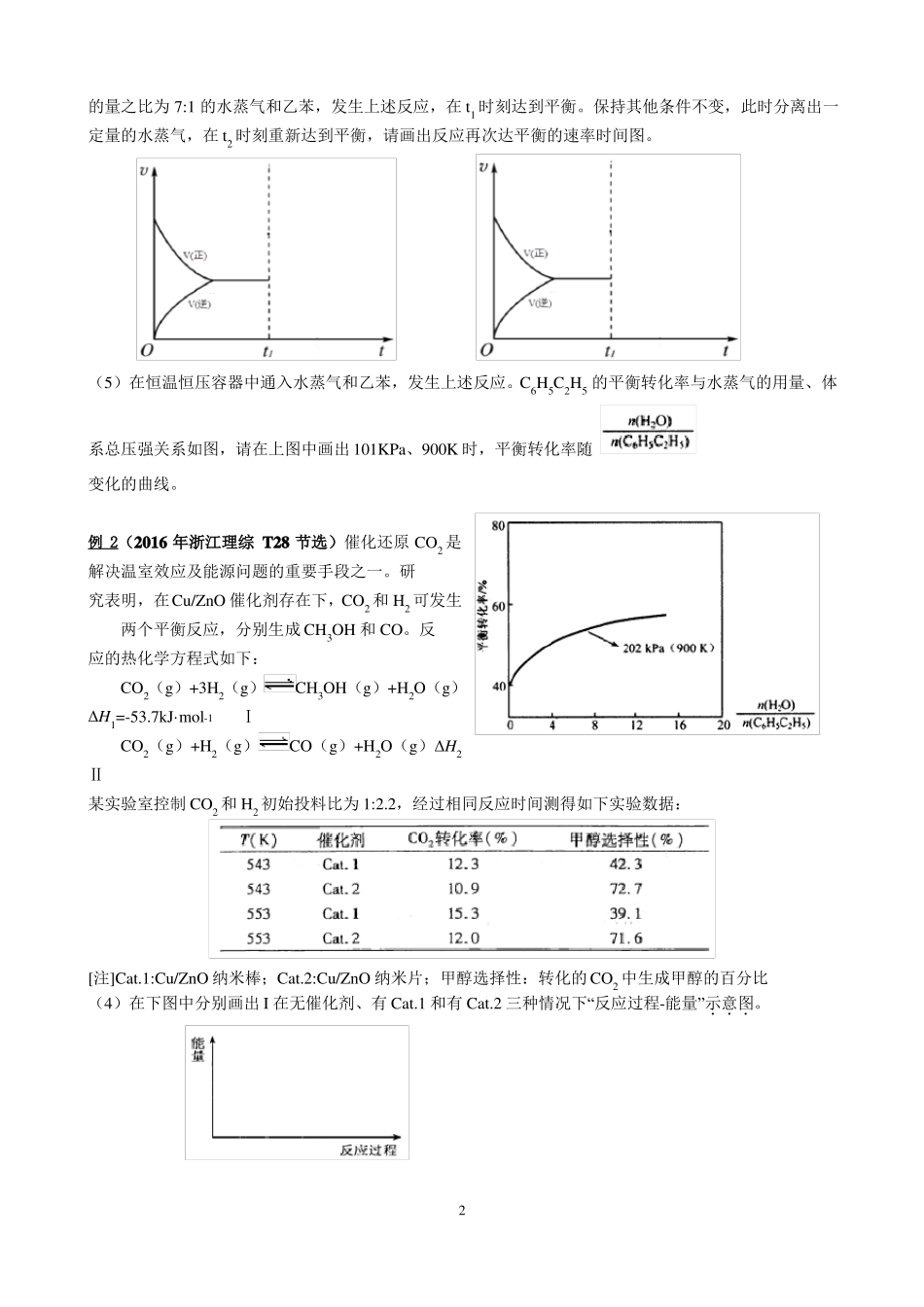
化学反应原理图像的绘制学案例 1 往恒温恒容,容积为 5L 的密闭容器中充入 3 mol NH3 和 1.5 mol CO2,发生反应:2NH3(g)+CO2(g)H2NCOONH4(s)ΔH=-159.47 kJ·mol下图所示。(1)25 min时再向该容器中充入1 mol NH3和0.5 mol CO2,在40 min时重新达到平衡,请在上图中画出25~50 min内NH3的浓度变化趋势曲线。(2)若氨基甲酸铵的状态为气态,其他条件与(1)中相同,请在上图中画出 25~50 min内 NH3 的浓度变化趋势曲线(不要求定量)。(3)图中虚线为该反应在使用催化剂条件下,起始 NH3、CO2 投料比和 NH3 平衡转化率的关系图。当其他条件完全相同时,用实线画出不使用催化剂情况下,起始NH3、CO2 投料比和 NH3 平衡转化率的关系示意图。-1一定条件下达到平衡状态。上述反应经 15 min 达到平衡,各物质浓度的变化曲线如练习1.工业上以乙苯为原料生产苯乙烯的反应如下:C6H5C2H5(g) C6H5CH=CH2(g)+H2(g);△H>0在恒温恒容容器中通入一定量的乙苯,发生上述反应,在 t1 时刻达到平衡。(1)若反应置于绝热体系中,试画出苯乙烯的质量分数随时间的变化图。(2)若在 1L 恒容容器中充入 0.100mol 乙苯气体,加热到一定温度后使之反应,假设乙苯平衡转化率为50%,请画出容器中气体的总浓度 c(总)随时间 t 变化的总趋势图。(3)在恒温恒容的密闭容器中,该反应达到平衡后,t1 时刻瞬间充入乙苯和苯乙烯,使它们的浓度增大一倍,试画出 t1 时刻后正逆反应速率的变化图像。(4)实际生产中以高温水蒸气作为反应体系的稀释剂(稀释剂不参加反应)。在恒温恒压容器中通入物质1的量之比为 7:1 的水蒸气和乙苯,发生上述反应,在 t1 时刻达到平衡。保持其他条件不变,此时分离出一定量的水蒸气,在 t2 时刻重新达到平衡,请画出反应再次达平衡的速率时间图。(5)在恒温恒压容器中通入水蒸气和乙苯,发生上述反应。C6H5C2H5 的平衡转化率与水蒸气的用量、体系总压强关系如图,请在上图中画出 101KPa、900K 时,平衡转化率随变化的曲线。例 2(2016 年浙江理综 T28 节选)催化还原 CO2 是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO 催化剂存在下,CO2 和 H2 可发生两个平衡反应,分别生成 CH3OH 和 CO。反应的热化学方程式如下:CO2(g)+3H2(g)ΔH1=-53.7kJ·mol-1ⅠCO2(g)+H2(g)Ⅱ某实验室控制 CO2 和 H2 初始投料比为 1:2.2,经过相同反应时间测得如下...