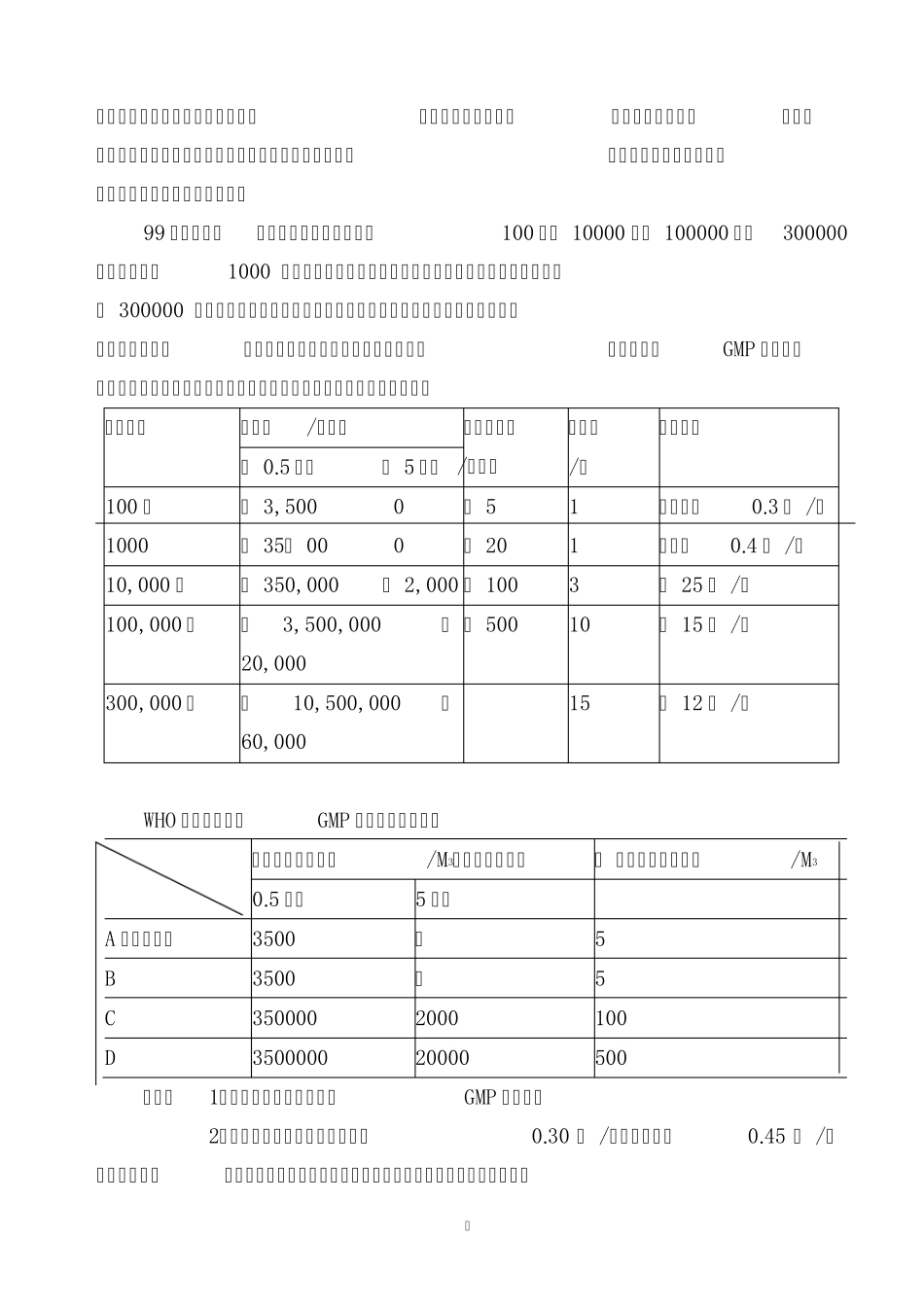
GMP 与洁净厂房的建设要求 一、GMP 的基本概念 GMP 是《优良药品生产标准》的英文Good manufacture Practice for Drugs的简称,我国制定为《药品生产质量管理规范》。《 GMP》 是在药品生产全过程中用科学、合理、规范化的条件和方法来保证生产优良药品的一整套科学管理方法和实施措施。实施GMP 的目的就是为了使用者能得到优质的药品,但又不是仅仅通过最终的检验来达到的,而是在药品生产的全过程实施科学的全程管理和严密的监控来获得预期质量的药品。因此GMP 要求药品生产企业必须从收进原料开始一直到制造、包装、贴标签、出厂等各项生产步骤和操作都制订出明确的准则和管理方法,同时通来严密的生产过程管理与质量管理来对上述各个环节实施正确的检查、监控和记录。 二、中国《GMP》的发展与历史 1988 年 8 月卫生部公布了我国第一部《药品生产质量管理规范》简称 《 GMP》规范,由于内容比较原则,因此1989 年—1990 年卫生部组织有关人员起草《实施细则》, 1991 年决定根据《规范》和《细则》的内容重新修订《药品生产质量管理规范》。 新修订的《药品生产质量管理规范》( 1992)已于1993 年 2 月 16 日颁布。 在以后的实践中逐步进行了修改,先后出版了(98)版《药品生产质量管理规范》和(1999/6/18)版《药品生产质量管理规范》,现今以99 版指导GMP的实施和认证。 三《药品生产质量管理规范》( 99 修订版)主要内容 新版《GMP》(即指1999/6/18 日修订版)既从我国的药品生产总体水平和即将加入世贸组织的特殊要求出发以严格坚持GMP 的基本准则为手段,与现代国际标准相接轨,敦促指导国内制药企业规范化、标准化和规模生产建设。 新版《GMP》对以下几方面进行了阐述:1 总则;2 人员;3 厂房;4 设备;5 卫生;6 原料、辅料及包装材料;7 生产管理;8 包装和贴签;9 生产管理和质量管理;10 文件质量管理部门;11 自检;12 销售记录;13 用户意见和不良反应报告;14 附录。 1 新规范参照世界卫生组织和发达国家GMP 的要求,规定了药品生产厂房的洁净度级别和适用于药品生产的种类和工序;对中药材的前处理、提取、浓缩及动物脏器、组织的洗涤或处理的厂房和有关生产操作要求作出了规定,对中成药生产的后续工序——制剂制造,在GMP 方面的要求与化学药品的制剂生产应相同;对药品包材也列入了GMP 的生产控制范围;生物制品的厂房、加工和灌装有其特殊的要求,因此也...