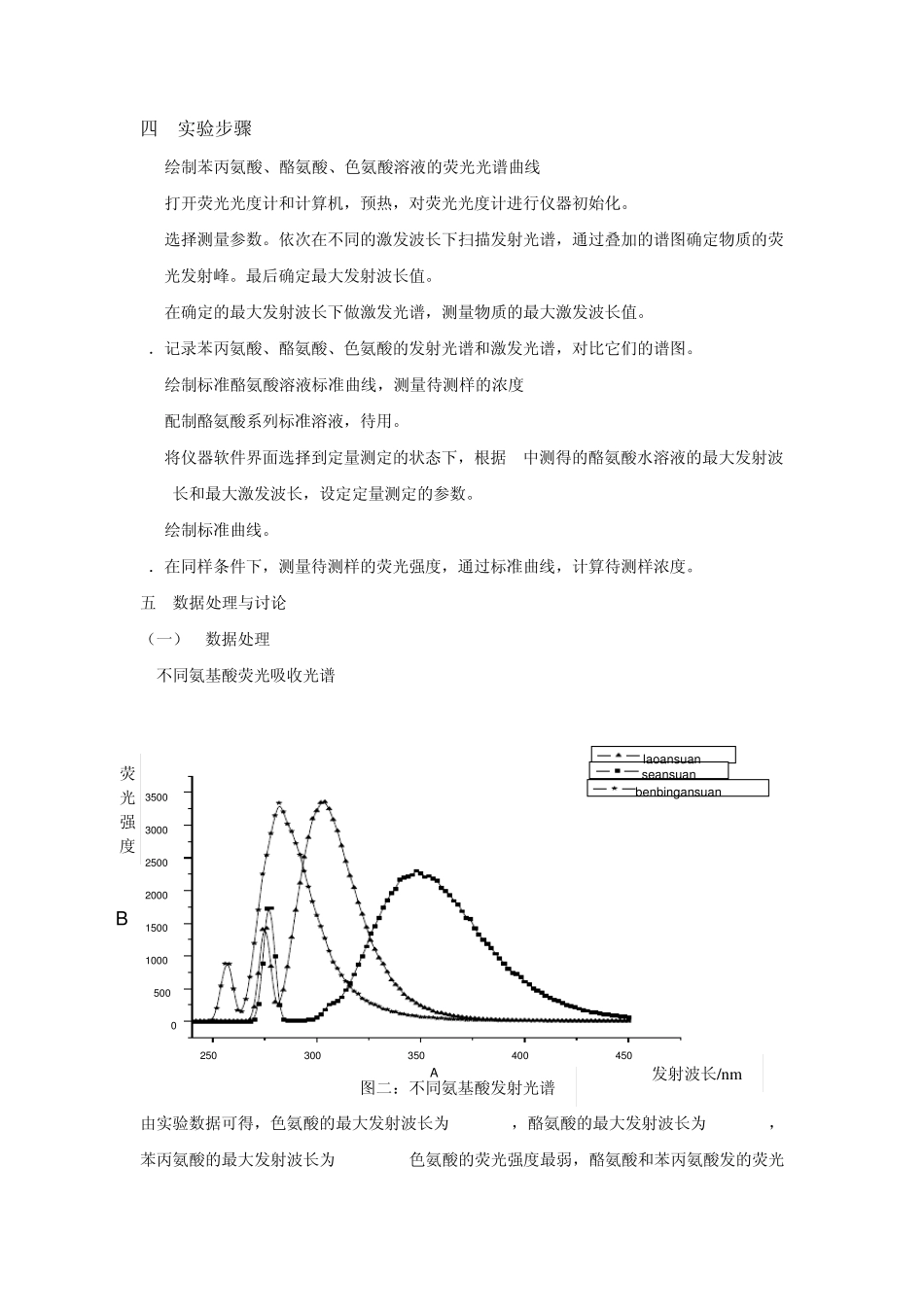
氨基酸类物质的分子荧光光谱分析 一 实验目的 1. 掌握分子荧光和紫外-可见分光光度法的分析原理,了解两者的区别与联系 2.熟悉分子荧光与紫外-可见分光光度计的结构及特点,掌握其使用方法。 3.掌握使用分子荧光和紫外吸收光谱标准曲线法定量测定物质含量的方法。 4.了解物质分子的组成、结构等对荧光光谱和紫外吸收光谱的影响。 5.了解分子荧光光谱与紫外-可见分光光度法在定量分析、分子结构分析以及应用范围方面各有哪些特点。 二 实验原理 荧光物质分子吸收了特定频率辐射能量后,由基态跃迁至第一电子激发态(或更高激发态)的任一振动能级,在溶液中这种激发态分子与溶剂分子发生碰撞,以热的形式损失部分能量后,而回到第一电子激发态的最低振动能级(无辐射跃迁)。然后再以辐射形式去活化跃迁到电子基态的任一振动能级,便产生荧光。如图 1。 图1. 吸收、荧光、磷光能级图 由于无辐射跃迁的几率大,因此分子荧光波长常常比激发光长。激发光源的波长通常是在紫外区,荧光也可能在紫外区,但更多是在可见区。相对于基态和激发态两个最低振动能级之间的跃迁所产生的荧光称为共振荧光,此时吸收光谱与荧光光谱重叠。 荧光的产生是由于物质在吸收了激发光部分能量后发射的波长相同或波长较长的光,因此,根据Lambert-Beer定律,溶液的荧光强度F与该溶液吸光的强度以及荧光物质的荧光效率φ (量子产率)成正比。在稀溶液中: F=2.3Kφ ε b cI0=2.3Kφ AI0 ε —荧光物质的吸光系数 b—液层厚度 I0—入射光强度 K—检测效率(由仪器决定) C-是样品浓度 当激发光强度一定,且浓度很小时,荧光强度与荧光物质浓度成正比。即 F=Kc。此关系只限于极稀溶液,对于较浓的溶液,其吸光度超过 0.05时,使荧光物质分子之间以及荧光物质分子同溶剂分子之间的碰撞增加,导致无辐射去活增加而发生自熄灭。 任何荧光物质都具有激发光谱和发射光谱。并且,由于处于基态和激发态的振动能级几乎具有相同的间隔,分子和轨道的对称性都没有改变,荧光化合物的发射光谱和激发光谱形式呈大同小异的“镜像对称”关系。 同一荧光物质的分子荧光光谱曲线的波长范围不因它的激发波长值的改变而位移。由于这一荧光特性,如果固定荧光最大发射波长,然后改变激发波长,从激发光谱中确定最大激发波长。反之,固定最大激发光波波长值,测定不同发射波长时的荧光强度,既得荧光发射光谱曲线和最大荧光发射波长值。 物质是否发生荧光...