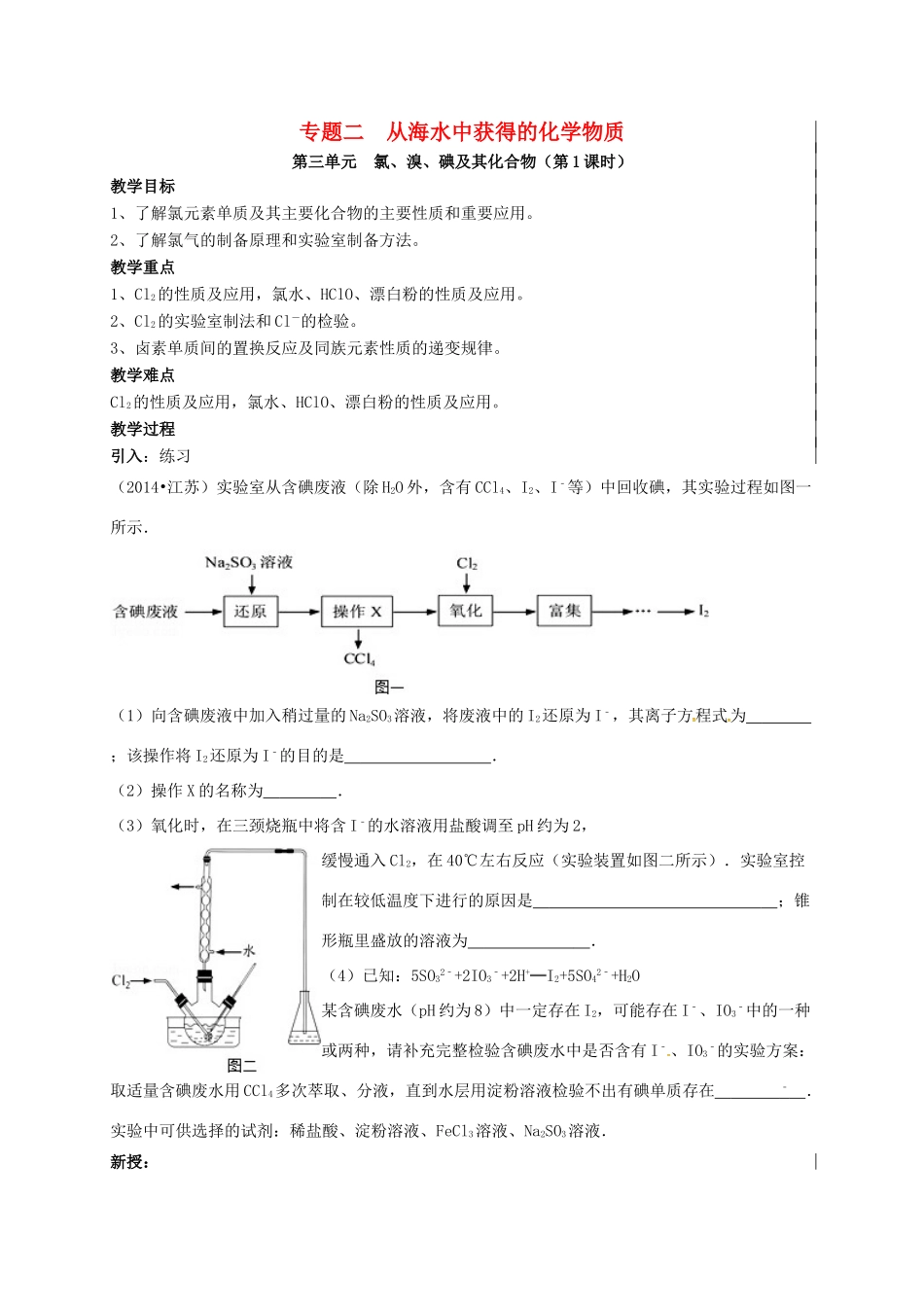
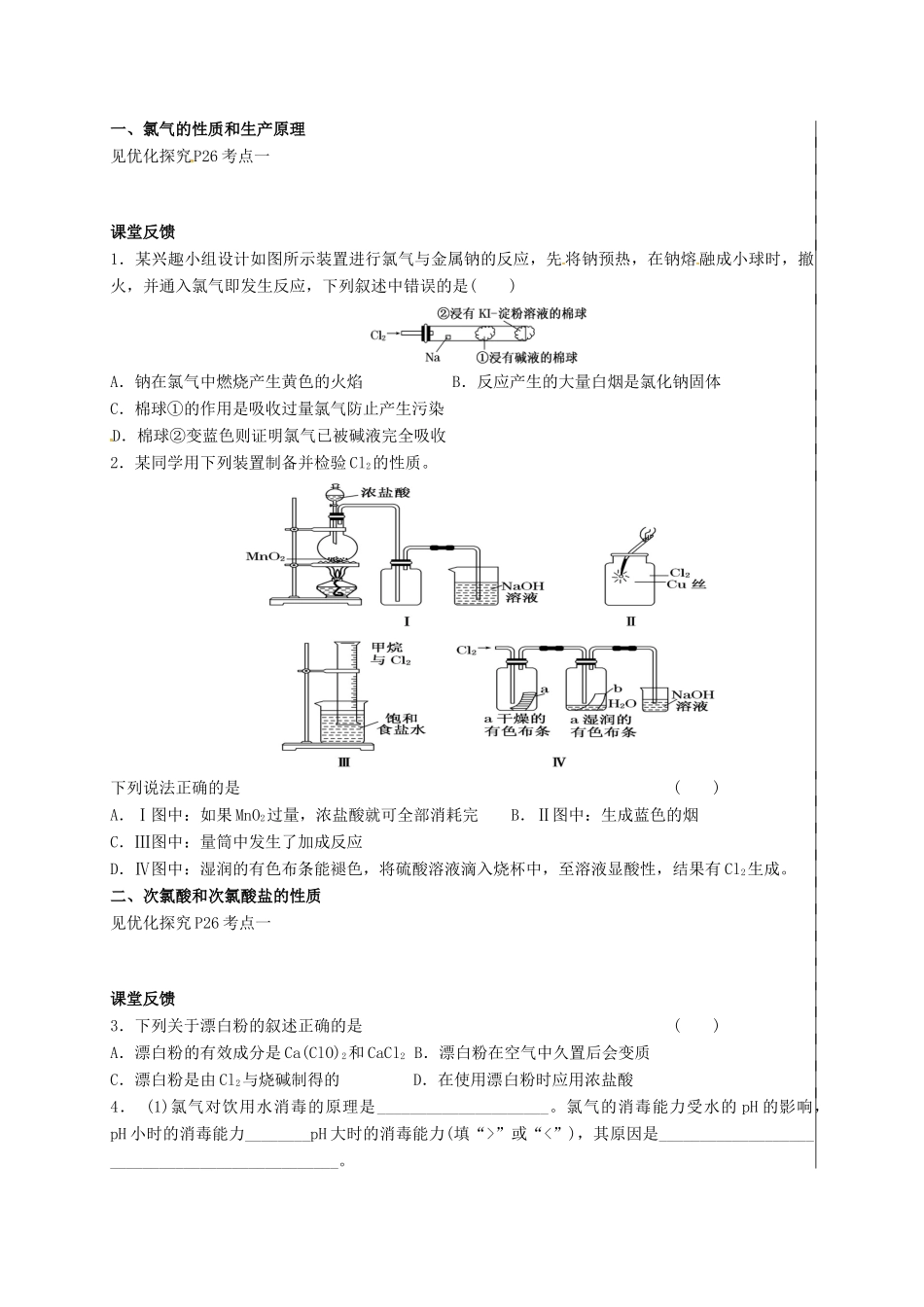
专题二 从海水中获得的化学物质第三单元 氯、溴、碘及其化合物(第 1 课时)教学目标1、了解氯元素单质及其主要化合物的主要性质和重要应用。2、了解氯气的制备原理和实验室制备方法。教学重点 1、Cl2的性质及应用,氯水、HClO、漂白粉的性质及应用。2、Cl2的实验室制法和 Cl-的检验。3、卤素单质间的置换反应及同族元素性质的递变规律。教学难点Cl2的性质及应用,氯水、HClO、漂白粉的性质及应用。教学过程引入:练习(2014•江苏)实验室从含碘废液(除 H2O 外,含有 CCl4、I2、I﹣等)中回收碘,其实验过程如图一所示.(1)向含碘废液中加入稍过量的 Na2SO3溶液,将废液中的 I2还原为 I﹣,其离子方程式为 ;该操作将 I2还原为 I﹣的目的是 .(2)操作 X 的名称为 .(3)氧化时,在三颈烧瓶中将含 I﹣的水溶液用盐酸调至 pH 约为 2,缓慢通入 Cl2,在 40℃左右反应(实验装置如图二所示).实验室控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 .(4)已知:5SO32﹣+2IO3﹣+2H+═I2+5SO42﹣+H2O某含碘废水(pH 约为 8)中一定存在 I2,可能存在 I﹣、IO3﹣中的一种或两种,请补充完整检验含碘废水中是否含有 I﹣、IO3﹣的实验方案:取适量含碘废水用 CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在 ﹣ .实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液.新授:一、氯气的性质和生产原理见优化探究P26 考点一课堂反馈1.某兴趣小组设计如图所示装置进行氯气与金属钠的反应,先 将钠预热,在钠熔 融成小球时,撤火,并通入氯气即发生反应,下列叙述中错误的是( )A.钠在氯气中燃烧产生黄色的火焰 B.反应产生的大量白烟是氯化钠固体C.棉球①的作用是吸收过量氯气防止产生污染D.棉球②变蓝色则证明氯气已被碱液完全吸收2.某同学用下列装置制备并检验 Cl2的性质。下列说法正确的是 ( )A.Ⅰ图中:如果 MnO2过量,浓盐酸就可全部消耗完 B.Ⅱ图中:生成蓝色的烟C.Ⅲ图中:量筒中发生了加成反应D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有 Cl2生成。二、次氯酸和次氯酸盐的性质见优化探究 P26 考点一课堂反馈3.下列关于漂白粉的叙述正确的是 ( )A.漂白粉的有效成分是 Ca(ClO)2和 CaCl2 B.漂白粉在空气中久置后会变质C.漂白粉是由 Cl2与烧碱制得的 D.在使用漂白粉时应用浓盐酸4. (1)氯气对饮用水消...