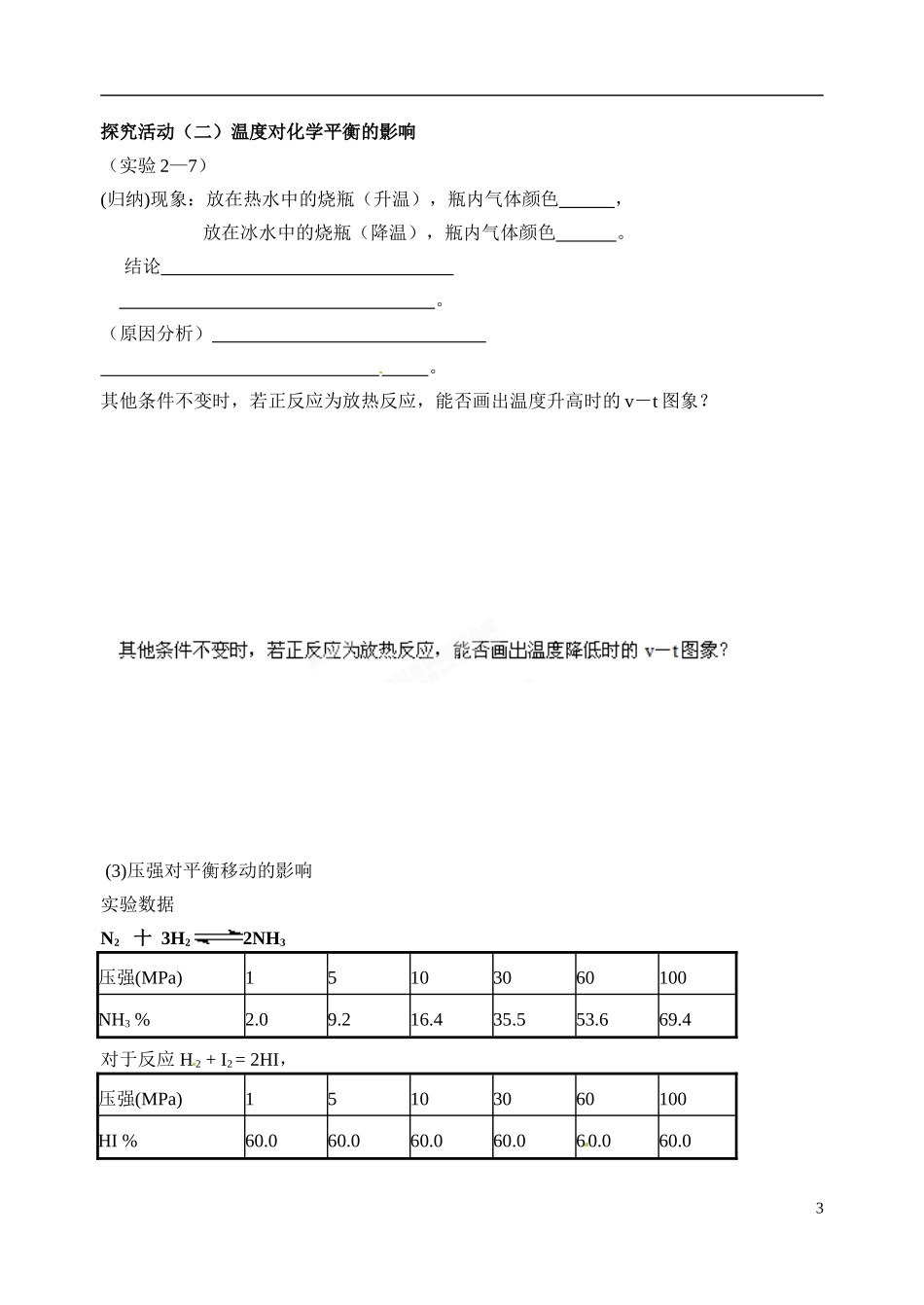
江苏省姜堰市蒋垛中学 2013-2014 学年高中化学 化学平衡 2(平衡移动)教学案 新人教版选修 4【教学目的】1.了解浓度、压强、温度等外界条件对化学平衡移动的影响。2.掌握用化学平衡的移动原理来定性定量地分析化学平衡问题。3.了解平衡移动原理的重要意义,学会解决问题的科学方法。【教学重点、难点】化学平衡移动原理【教学过程】(复习)化学平衡状态的概念 化学平衡状态的特征(设疑)化学平衡状态的特征之一是“变”含义是什么?化学平衡状态是受外界条件影响的。当外界条件发生改变时,平衡状态是否也发生改变呢?如何改变?这就是我们本节课要探究的内容。(1)浓度对平衡移动的影响探究活动(一)浓度对化学平衡的影响(实验 2—5)已知在 K2Cr2O7溶液中存在如下平衡 取两支试管各加入 5mL 0.1 mol/L K2Cr2O7溶液,然后按下表步骤操作,观察并记录溶液颜色的变化。编号12步骤滴加 3—10 滴浓硫酸滴加 10—20 滴 6 mol/L NaOH现象(结论)浓度发生改变,化学平衡状态也随之发生改变。我们说,平衡发生移动了。(图像分析)增加生成物浓度 减小生成物浓度(设疑)若增加若减小生成物浓度,是否也会使平衡发生移动呢?1(实验 2—6)向盛有 5 mL 0.005 mol/L FeCl3溶液的试管中加入 5 mL 0.01mol/L 的 KSCN 溶液,溶液呈红色。存在一个平衡 将上述溶液均分置于两支试管中。然后按下表进行操作,观察溶液的颜色变化。编号12步骤 1滴加饱和 FeCl3溶液滴加 1mol/L 的 KSCN 溶液现象步骤 2滴加 NaOH 溶液滴加 NaOH 溶液现象结论(图像分析)增加反应物浓度 减小反应物浓度(归纳)结论:浓度对化学平衡的影响 。 (强调) 浓度对化学平衡移动的几个注意点① 对平衡体系中的固态和纯液态物质,其浓度可看作 一个常数,增加或减小固态或液态纯净物的量并不 影响 V 正、V 逆的大小,所以化学平衡不移动。② 只要是增大浓度,不论增大的是反应物浓度,还是生成物浓度,新平衡状态下的反应速率一定大于原 平衡状态;减小浓度,新平衡状态下的速率一定小于原平衡状态。③ 反应物有两种或两种以上, 增加一种物质的浓度, 该物质的平衡转化率降低, 而其他物质的转化率提高。④ 改变浓度后,速率-时间图象是连续的。(讲述)应用 (2)温度对平衡移动的影响2探究活动(二)温度对化学平衡的影响(实验 2—7)(归纳)现象:放在热水中的烧瓶(升温),瓶内气体颜色 , 放在冰水中的烧瓶...