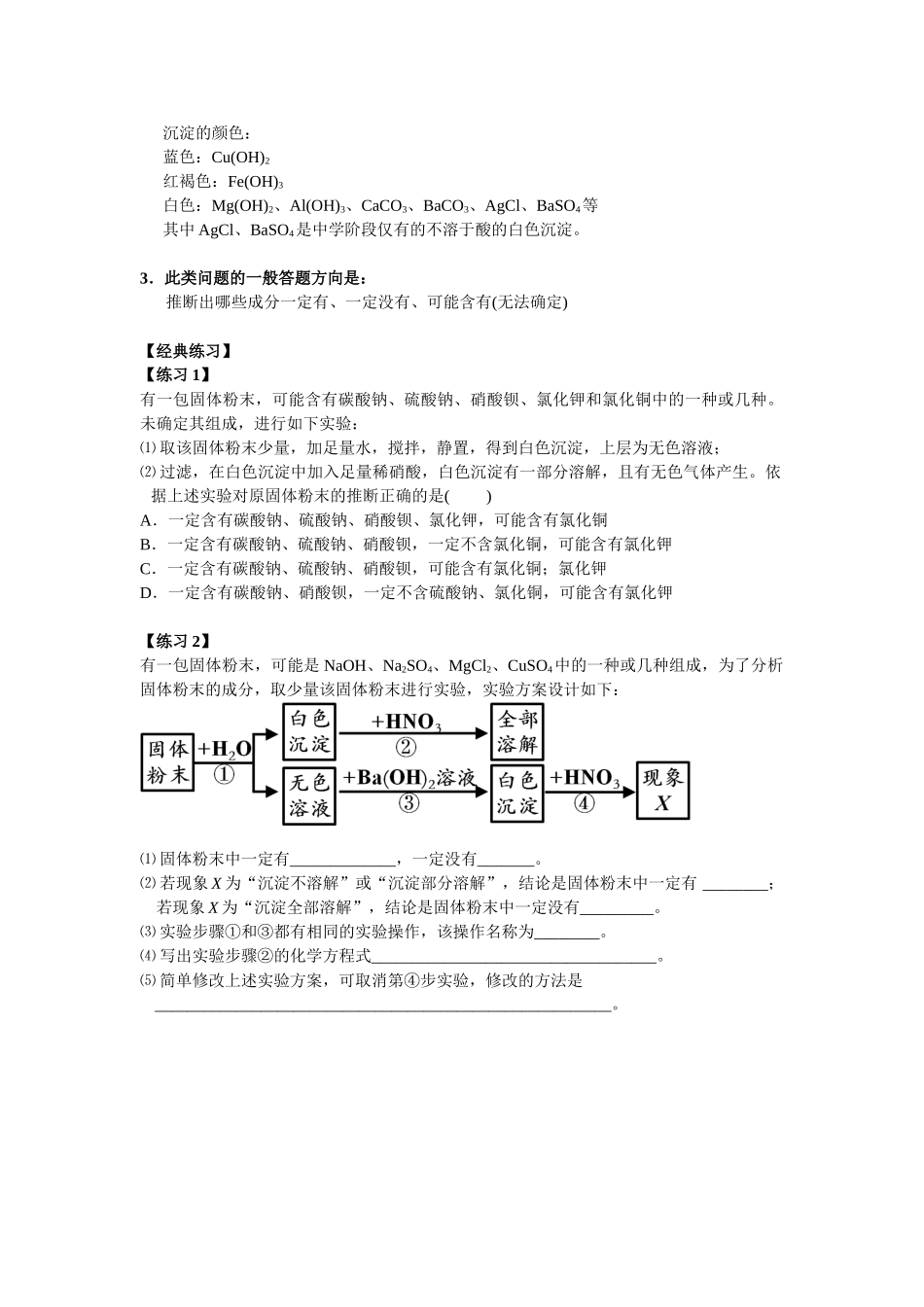
【经典例题】有一包固体粉末,可能由 CaCO3、Na2SO4、KNO3、CuSO4、BaCl2中的一种或几种组成,做实验得以下结果:⑴ 将此固体粉末加到水中,得到白色沉淀,且上层清液为无色;⑵ 该白色沉淀部分溶于稀硝酸,并有无色气体产生。 据此实验,得出的下列推断中正确的是( ) A.粉末中一定含有 CaCO3、Na2SO4、BaCl2 B.该粉末中一定不含有 KNO3、CuSO4 C.该粉末的组成中可能含有 KNO3 D.该粉末中一定含有 Na2SO4、KNO3、BaCl2 【应用小结】1.此类问题的主要考点是复分解反应复分解反应:⑴ 定义:两种化合物相互交换成分生成另外两种化合物的反应。⑵ 条件a.生成气体b.生成水c.生成沉淀(生成不溶于水的物质) 不溶于水的(沉淀的)物质初中阶段:酸:全部可溶碱:除了强碱:KOH、NaOH、Ca(OH)2、Ba(OH)2;弱碱(NH3 H2O)外其余的碱基本都不溶于水。盐:强酸盐:盐酸盐(Cl-):AgCl(白色沉淀),其余基本都可溶于水硫酸盐(SO42-):BaSO4(白色沉淀),其余基本都可溶于水硝酸盐(NO3-):全部可以溶于水弱酸盐:除了阳离子为 Na+、K+、NH4+的弱酸盐可以溶于水外,其余的基本都不溶于水。 2.此类问题的突破口一般是看常见的实验现象,主要以溶液的颜色,沉淀的颜色,及是否生成气体来体现 有颜色的溶液: (初中阶段,含有下列离子的溶液通常有颜色) Fe2+:浅绿色; Fe3+:黄色; Cu2+:蓝色; MnO4-:紫红色 酸碱盐应用之混合物成分判定沉淀的颜色: 蓝色:Cu(OH)2 红褐色:Fe(OH)3 白色:Mg(OH)2、Al(OH)3、CaCO3、BaCO3、AgCl、BaSO4等 其中 AgCl、BaSO4是中学阶段仅有的不溶于酸的白色沉淀。 3.此类问题的一般答题方向是: 推断出哪些成分一定有、一定没有、可能含有(无法确定) 【经典练习】 【练习 1】 有一包固体粉末,可能含有碳酸钠、硫酸钠、硝酸钡、氯化钾和氯化铜中的一种或几种。未确定其组成,进行如下实验:⑴ 取该固体粉末少量,加足量水,搅拌,静置,得到白色沉淀,上层为无色溶液;⑵ 过滤,在白色沉淀中加入足量稀硝酸,白色沉淀有一部分溶解,且有无色气体产生。依据上述实验对原固体粉末的推断正确的是( ) A.一定含有碳酸钠、硫酸钠、硝酸钡、氯化钾,可能含有氯化铜B.一定含有碳酸钠、硫酸钠、硝酸钡,一定不含氯化铜,可能含有氯化钾 C.一定含有碳酸钠、硫酸钠、硝酸钡,可能含有氯化铜;氯化钾 D.一定含有碳酸钠、硝酸钡,一定不含硫酸钠、氯化铜,可能含有氯化钾 【练习 2】...