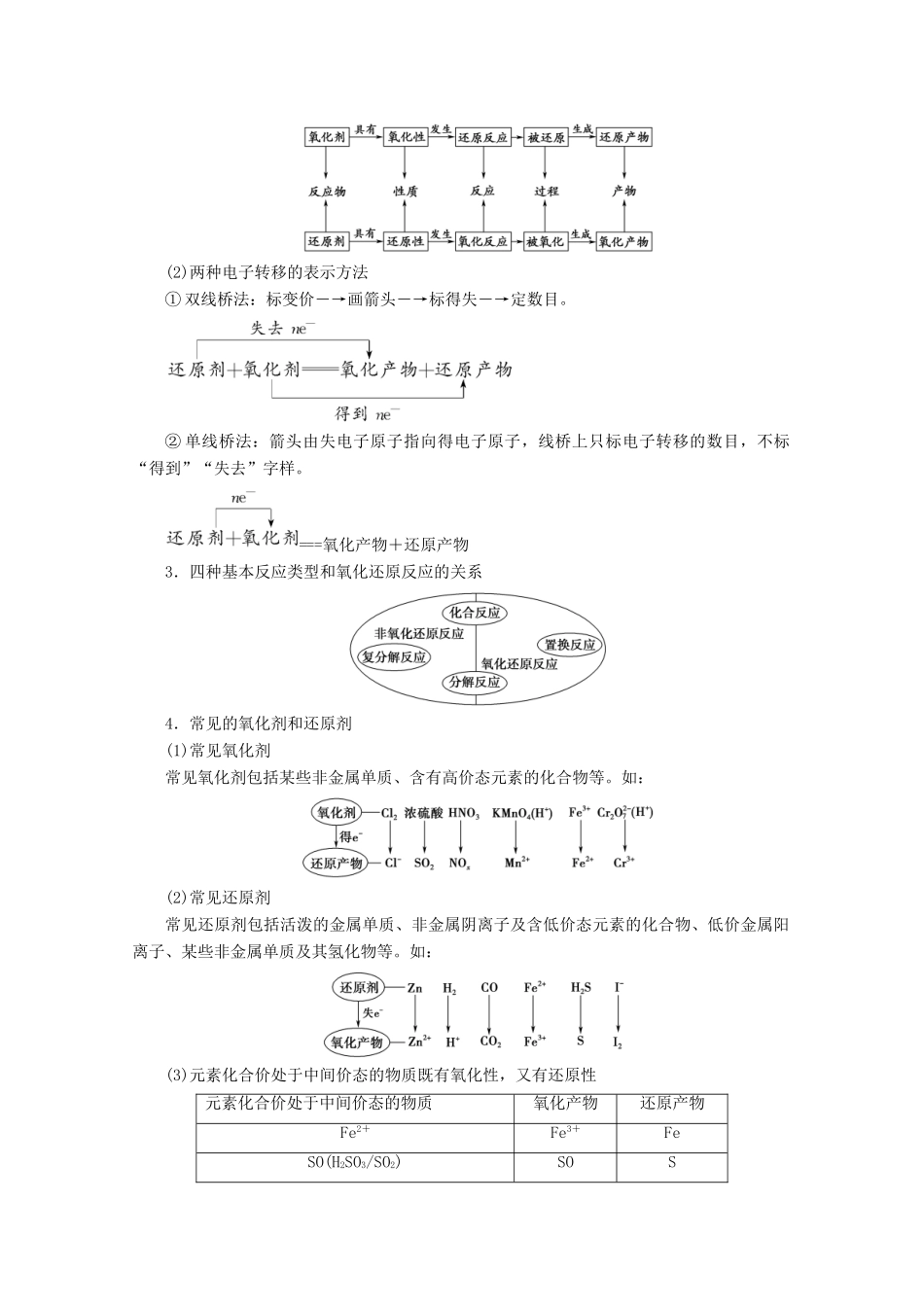
第 4 节 氧化剂和还原剂考纲定位核心素养1.了解氧化还原反应的本质。2.了解常见的氧化还原反应。根据化学式判断元素化合价。3.掌握常见氧化还原反应的配平和相关计算。4.能正确书写氧化还原化学方程式和离子方程式。1.模型认知——根据氧化还原反应的本质认识“价态规律,强弱规律,守恒规律”三大规律及应用的思维模型。2.证据推理——根据某些事实和信息归纳推导氧化性或还原性的强弱问题。3.科学探究——科学探究是认识氧化还原反应的重要途径。从氧化还原反应的角度设计探究方案,进行实验探究加深性质的理解与深化。考点一| 氧化还原反应的概念与本质1.本质和特征2.有关概念及联系对于反应 C+2H2SO4(浓)=====2SO2↑+CO2↑+2H2O(1)氧化剂是浓硫酸,发生还原反应,被还原,生成还原产物 SO2。(2)还原剂是 C,发生氧化反应,被氧化,生成氧化产物 CO2。(3)C 和浓硫酸在反应中分别表现还原性和氧化性。(4)反应生成 1 mol CO2,浓硫酸得 4_mol 电子,C 失去 4_mol 电子,反应转移 4_mol 电子。(5)① 单线桥法表示电子转移的方向与数目为 (浓)=====2SO2↑+CO2↑+2H2O② 双线桥法表示电子转移的方向与数目为[深度归纳] (1)有关概念与联系(2)两种电子转移的表示方法① 双线桥法:标变价―→画箭头―→标得失―→定数目。② 单线桥法:箭头由失电子原子指向得电子原子,线桥上只标电子转移的数目,不标“得到”“失去”字样。===氧化产物+还原产物3.四种基本反应类型和氧化还原反应的关系4.常见的氧化剂和还原剂(1)常见氧化剂常见氧化剂包括某些非金属单质、含有高价态元素的化合物等。如:(2)常见还原剂常见还原剂包括活泼的金属单质、非金属阴离子及含低价态元素的化合物、低价金属阳离子、某些非金属单质及其氢化物等。如:(3)元素化合价处于中间价态的物质既有氧化性,又有还原性元素化合价处于中间价态的物质氧化产物还原产物Fe2+Fe3+FeSO(H2SO3/SO2)SOSH2O2O2H2O其中 Fe2+、SO(H2SO3/SO2)主要表现还原性,H2O2主要表现氧化性。1.正误判断(正确的打“√”,错误的打“×”)(1)氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原。( )(2)某元素从游离态变为化合态,该元素可能被氧化也可能被还原。( )(3)金属阳离子只有氧化性,发生还原反应。( )(4)Na2O2与 H2O 反应,NO2与 H2O 反应中氧化剂与还原剂均为一种物质。( )(5)在 Cl2+2NaOH===NaCl+NaClO+H2O 反应中,1 mol Cl2反应转...