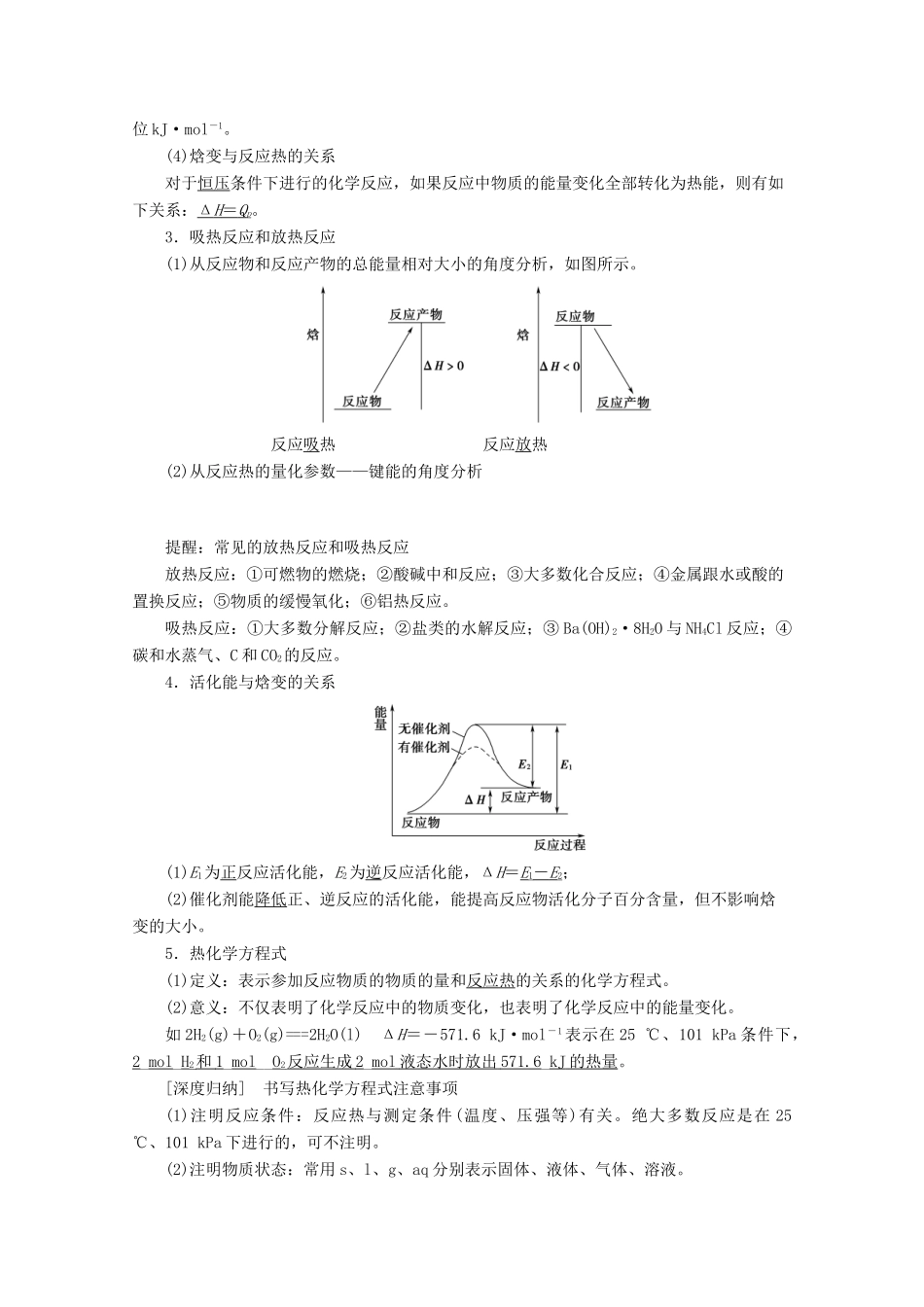
第 1 节 化学反应的热效应考纲定位核心素养1.了解化学反应中能量转化的原因及常见的能量转化形式。2.了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念。3.了解热化学方程式的含义,能正确书写热化学方程式。4.了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用。5.了解焓变(ΔH)与反应热的含义。了解活化能的概念。6.理解盖斯定律,并能运用盖斯定律进行有关反应焓变的计算。1.变化观念——认识化学变化的本质是有新物质生成,并伴有能量的转化;能多角度、动态地分析热化学反应方程式,运用热化学反应原理解决实际问题。2.模型认知——认识盖斯定律应用及推导目标反应的热化学方程式的思维模型。3.社会责任——关注能源的合理开发利用,具有可持续的能源发展意识,利用化学知识开发利用新能源。考点一| 焓变 热化学方程式1.化学反应中的能量变化(1)化学反应中的两大变化:物质变化和能量变化。(2)化学反应中的两大守恒:质量守恒和能量守恒。(3)化学反应中的能量转化形式① 吸热反应:热能―→化学能。② 放热反应:化学能―→热能。③ 光合作用:光能―→化学能。④ 燃烧反应:化学能―→热能,化学能―→光能。⑤ 原电池反应:化学能―→电能。⑥ 电解池反应:电能―→化学能。(4)化学反应的实质与特征2.焓变、反应热(1)焓(H)用于描述物质所具有能量的物理量。(2)焓变(ΔH)ΔH=H ( 反应产物 ) - H ( 反应物 ) 。单位 kJ·mol-1或 kJ/mol-1。(3)反应热指当化学反应在一定温度下进行时,反应所放出或吸收的热量,通常用符号 Q 表示,单位 kJ·mol-1。(4)焓变与反应热的关系对于恒压条件下进行的化学反应,如果反应中物质的能量变化全部转化为热能,则有如下关系:Δ H = Q p。3.吸热反应和放热反应(1)从反应物和反应产物的总能量相对大小的角度分析,如图所示。反应吸热 反应放热(2)从反应热的量化参数——键能的角度分析提醒:常见的放热反应和吸热反应放热反应:①可燃物的燃烧;②酸碱中和反应;③大多数化合反应;④金属跟水或酸的置换反应;⑤物质的缓慢氧化;⑥铝热反应。吸热反应:①大多数分解反应;②盐类的水解反应;③ Ba(OH)2·8H2O 与 NH4Cl 反应;④碳和水蒸气、C 和 CO2的反应。4.活化能与焓变的关系(1)E1为正反应活化能,E2为逆反应活化能,ΔH=E1- E 2;(2)催化剂能降低正、逆反应的活化能,能提高反应物活化分子百分含...