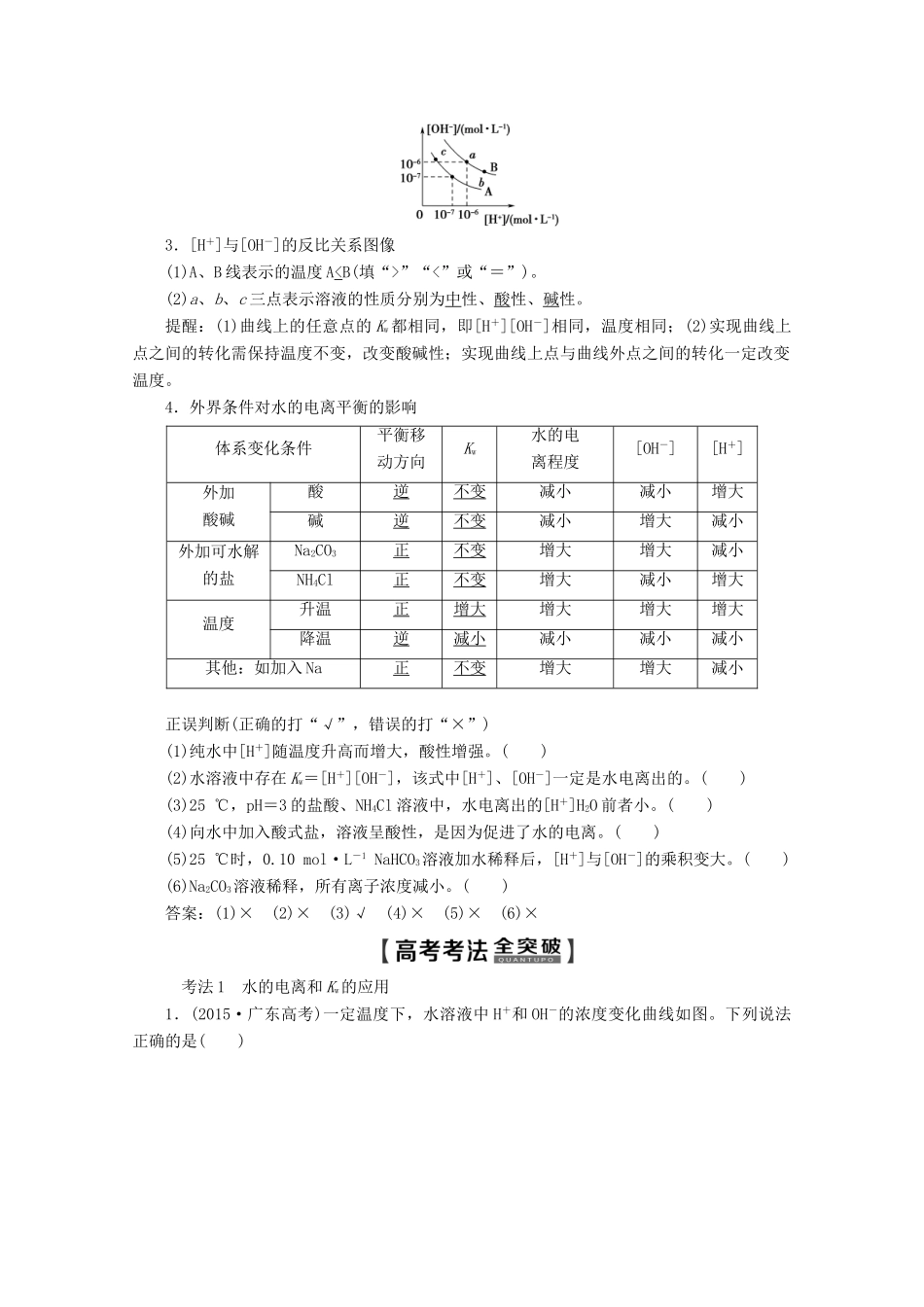
第 1 节 水溶液 酸碱中和滴定考纲定位核心素养1.了解水的电离,离子积常数。2.了解溶液 pH 的定义及其测定方法。能进行 pH的简单计算。3.掌握酸碱中和滴定实验及其应用。1.平衡思想——认识水的电离有一定限度,是可以调控的。能多角度、动态地分析水的电离,运用平衡移动原理解决实际问题。2.证据推理——根据溶液中的 pH 进行推导[H+]H2O 或[OH-]H2O 的大小。3.科学探究——利用中和滴定实验探究未知浓度的测定方法和原理。交流实验成果和数据,进一步探究和改进实验设想。4.科学精神——具有严谨求实的科学态度,不迷信权威数据。考点一| 水的电离1.水的电离2.水的离子积提醒:在不同溶液中,[H+]、[OH-]可能不同,但任何溶液中由水电离产生的[H+]、[OH-]总是相等的。在 Kw的表达式中,[H+]、[OH-]均表示整个溶液中 H+、OH-总的物质的量浓度而不是单指由水电离出的[H+]、[OH-]。3.[H+]与[OH-]的反比关系图像(1)A、B 线表示的温度 A”“<”或“=”)。(2)a、b、c 三点表示溶液的性质分别为中性、酸性、碱性。提醒:(1)曲线上的任意点的 Kw都相同,即[H+][OH-]相同,温度相同;(2)实现曲线上点之间的转化需保持温度不变,改变酸碱性;实现曲线上点与曲线外点之间的转化一定改变温度。4.外界条件对水的电离平衡的影响体系变化条件 平衡移动方向Kw水的电离程度[OH-][H+]外加酸碱酸逆不变减小减小增大碱逆不变减小增大减小外加可水解的盐Na2CO3正不变增大增大减小NH4Cl正不变增大减小增大温度升温正增大增大增大增大降温逆减小减小减小减小其他:如加入 Na正不变增大增大减小正误判断(正确的打“√”,错误的打“×”)(1)纯水中[H+]随温度升高而增大,酸性增强。( )(2)水溶液中存在 Kw=[H+][OH-],该式中[H+]、[OH-]一定是水电离出的。( )(3)25 ℃,pH=3 的盐酸、NH4Cl 溶液中,水电离出的[H+]H2O 前者小。( )(4)向水中加入酸式盐,溶液呈酸性,是因为促进了水的电离。( )(5)25 ℃时,0.10 mol·L-1 NaHCO3溶液加水稀释后,[H+]与[OH-]的乘积变大。( )(6)Na2CO3溶液稀释,所有离子浓度减小。( )答案:(1)× (2)× (3)√ (4)× (5)× (6)×考法 1 水的电离和 Kw的应用1.(2015·广东高考)一定温度下,水溶液中 H+和 OH-的浓度变化曲线如图。下列说法正确的是( )A.升高温度,可能引起由 c 向 b 的变化B.该温度下,水的离子积常数为 1.0×10-1...