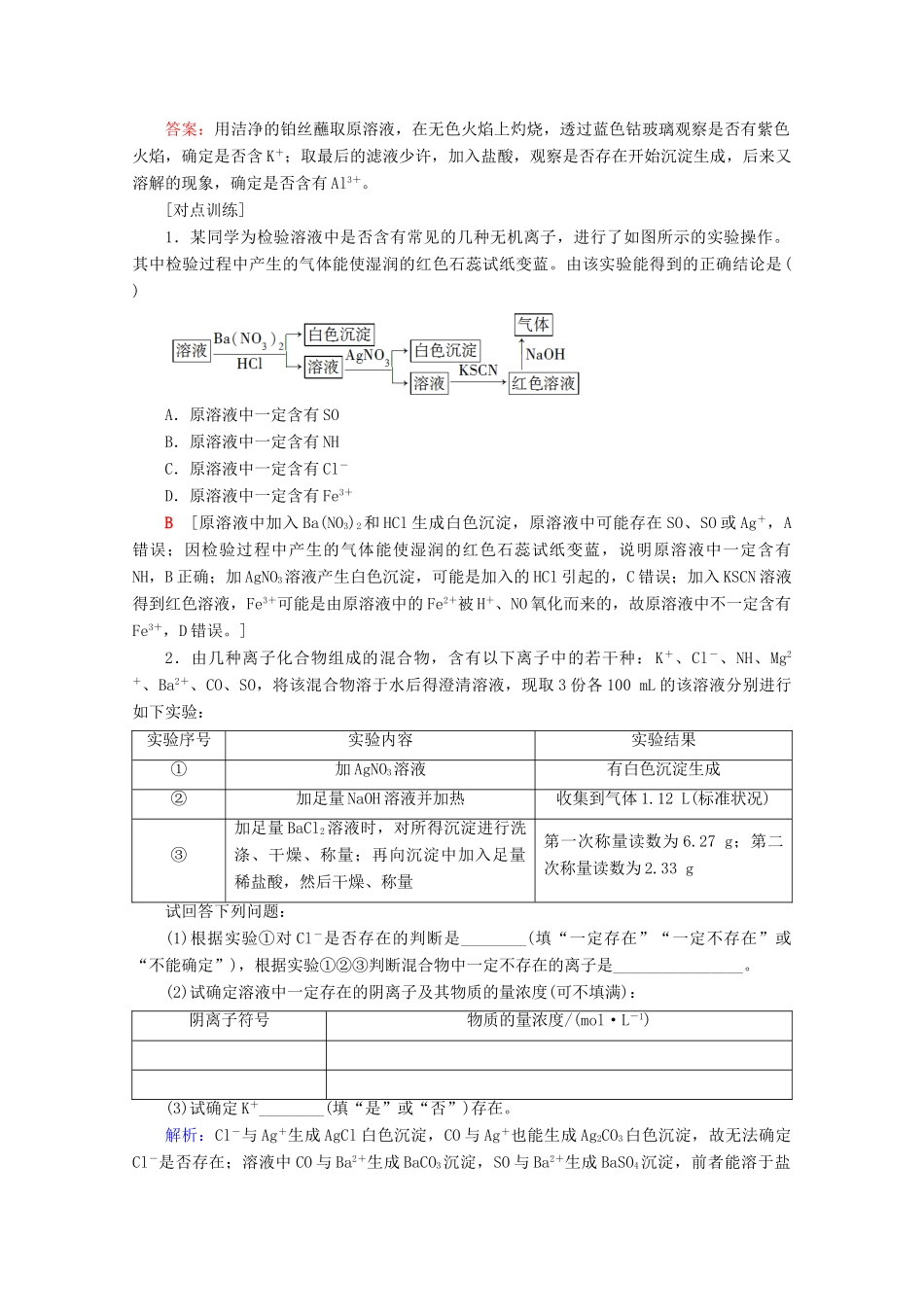
“四项基本原则”突破离子推断[典例导航]某溶液中可能含有 Cl-、SO、CO、NH、Fe3+、Al3+和 K+。取该溶液 100 mL,加入过量NaOH 溶液,加热,得到 0.02 mol 气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到 1.6 g 固体;向上述滤液中加足量 BaCl2溶液,得到 4.66 g 不溶于盐酸的沉淀。由此可知原溶液中( )A.至少存在 5 种离子B.Cl-一定存在,且 c(Cl-)≥0.4 mol·L-1C.SO、NH 一定存在,Cl-可能不存在D.CO、Al3+一定不存在,K+可能存在[思路点拨] B [根据加入过量 NaOH 溶液,加热,得到 0.02 mol 气体,说明有 NH,为 0.02 mol,同时产生红褐色沉淀,说明有 Fe3+,而且为 0.02 mol,则没有 CO;根据不溶于盐酸的 4.66 g沉淀,说明有 SO,且为 0.02 mol,则根据电荷守恒可知一定有 Cl-,至少有 0.04 mol,B 正确。]通过补什么实验步骤可确定是否含有 K+、Al3+?答案:用洁净的铂丝蘸取原溶液,在无色火焰上灼烧,透过蓝色钴玻璃观察是否有紫色火焰,确定是否含 K+;取最后的滤液少许,加入盐酸,观察是否存在开始沉淀生成,后来又溶解的现象,确定是否含有 Al3+。[对点训练]1.某同学为检验溶液中是否含有常见的几种无机离子,进行了如图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是( )A.原溶液中一定含有 SOB.原溶液中一定含有 NHC.原溶液中一定含有 Cl-D.原溶液中一定含有 Fe3+B [原溶液中加入 Ba(NO3)2和 HCl 生成白色沉淀,原溶液中可能存在 SO、SO 或 Ag+,A错误;因检验过程中产生的气体能使湿润的红色石蕊试纸变蓝,说明原溶液中一定含有NH,B 正确;加 AgNO3溶液产生白色沉淀,可能是加入的 HCl 引起的,C 错误;加入 KSCN 溶液得到红色溶液,Fe3+可能是由原溶液中的 Fe2+被 H+、NO 氧化而来的,故原溶液中不一定含有Fe3+,D 错误。]2.由几种离子化合物组成的混合物,含有以下离子中的若干种: K+、Cl-、NH、Mg2+、Ba2+、CO、SO,将该混合物溶于水后得澄清溶液,现取 3 份各 100 mL 的该溶液分别进行如下实验:实验序号实验内容实验结果①加 AgNO3溶液有白色沉淀生成②加足量 NaOH 溶液并加热收集到气体 1.12 L(标准状况)③加足量 BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加入足量稀盐酸,然后干燥、称量第一次称量读数为 6.27 g;第...