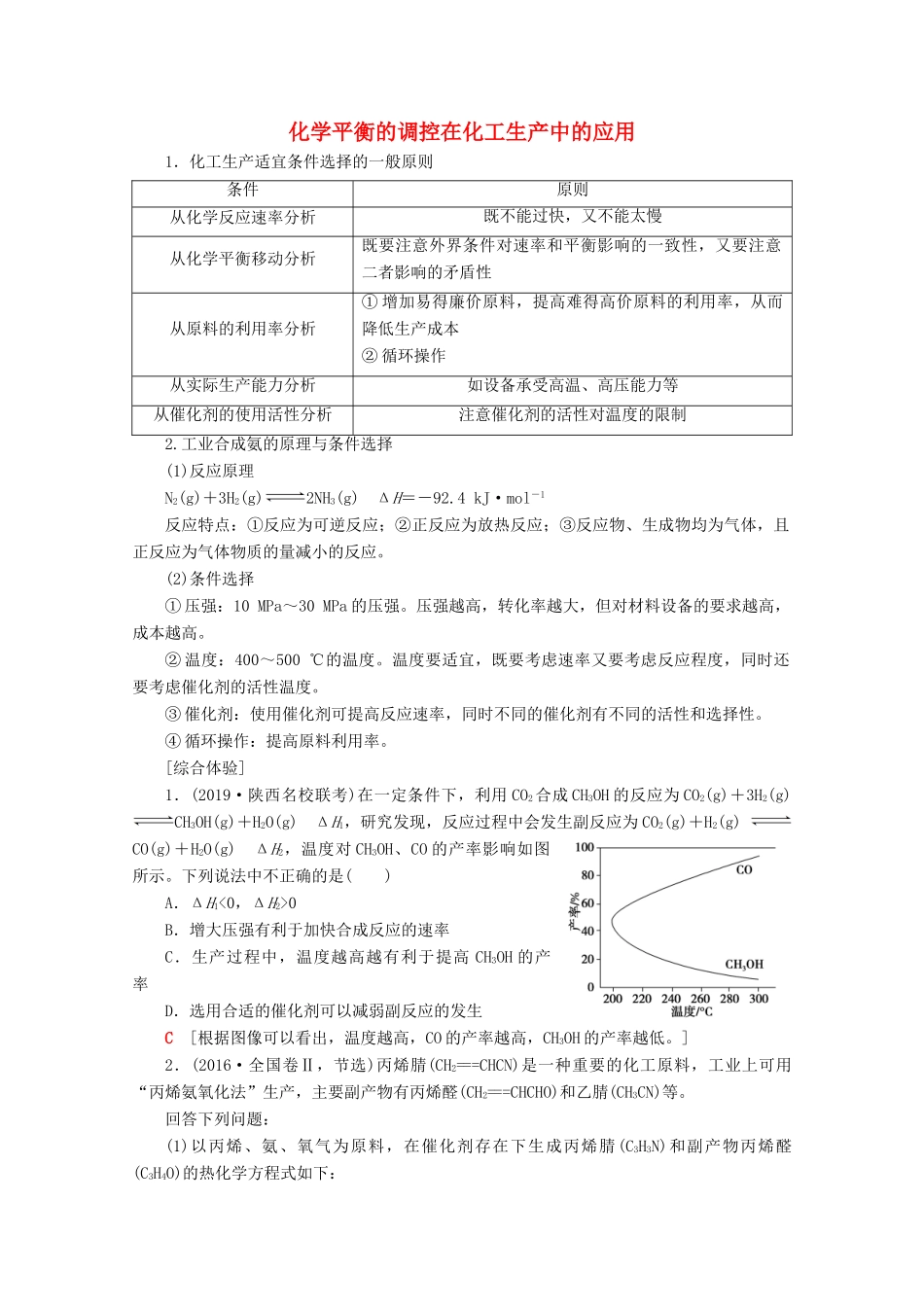
化学平衡的调控在化工生产中的应用1.化工生产适宜条件选择的一般原则条件原则从化学反应速率分析既不能过快,又不能太慢从化学平衡移动分析既要注意外界条件对速率和平衡影响的一致性,又要注意二者影响的矛盾性从原料的利用率分析① 增加易得廉价原料,提高难得高价原料的利用率,从而降低生产成本② 循环操作从实际生产能力分析如设备承受高温、高压能力等从催化剂的使用活性分析注意催化剂的活性对温度的限制2.工业合成氨的原理与条件选择(1)反应原理N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1反应特点:①反应为可逆反应;②正反应为放热反应;③反应物、生成物均为气体,且正反应为气体物质的量减小的反应。(2)条件选择① 压强:10 MPa~30 MPa 的压强。压强越高,转化率越大,但对材料设备的要求越高,成本越高。② 温度:400~500 ℃的温度。温度要适宜,既要考虑速率又要考虑反应程度,同时还要考虑催化剂的活性温度。③ 催化剂:使用催化剂可提高反应速率,同时不同的催化剂有不同的活性和选择性。④ 循环操作:提高原料利用率。[综合体验]1.(2019·陕西名校联考)在一定条件下,利用 CO2合成 CH3OH 的反应为 CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1,研究发现,反应过程中会发生副反应为 CO2(g)+H2(g) CO(g)+H2O(g) ΔH2,温度对 CH3OH、CO 的产率影响如图所示。下列说法中不正确的是( )A.ΔH1<0,ΔH2>0B.增大压强有利于加快合成反应的速率C.生产过程中,温度越高越有利于提高 CH3OH 的产率D.选用合适的催化剂可以减弱副反应的发生C [根据图像可以看出,温度越高,CO 的产率越高,CH3OH 的产率越低。]2.(2016·全国卷Ⅱ,节选)丙烯腈(CH2===CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2===CHCHO)和乙腈(CH3CN)等。回答下列问题:(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:①C3H6(g)+NH3(g)+O2(g)===C3H3N(g)+3H2O(g) ΔH=-515 kJ·mol-1②C3H6(g)+O2(g)===C3H4O(g)+H2O(g) ΔH=-353 kJ·mol-1有利于提高丙烯腈平衡产率的反应条件是__________;提高丙烯腈反应选择性的关键因素是________。(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为 460 ℃。低于460 ℃时,丙烯腈的产率________(填“是”或“不是”)对应温度下的平衡产率,判断理由是_____________...