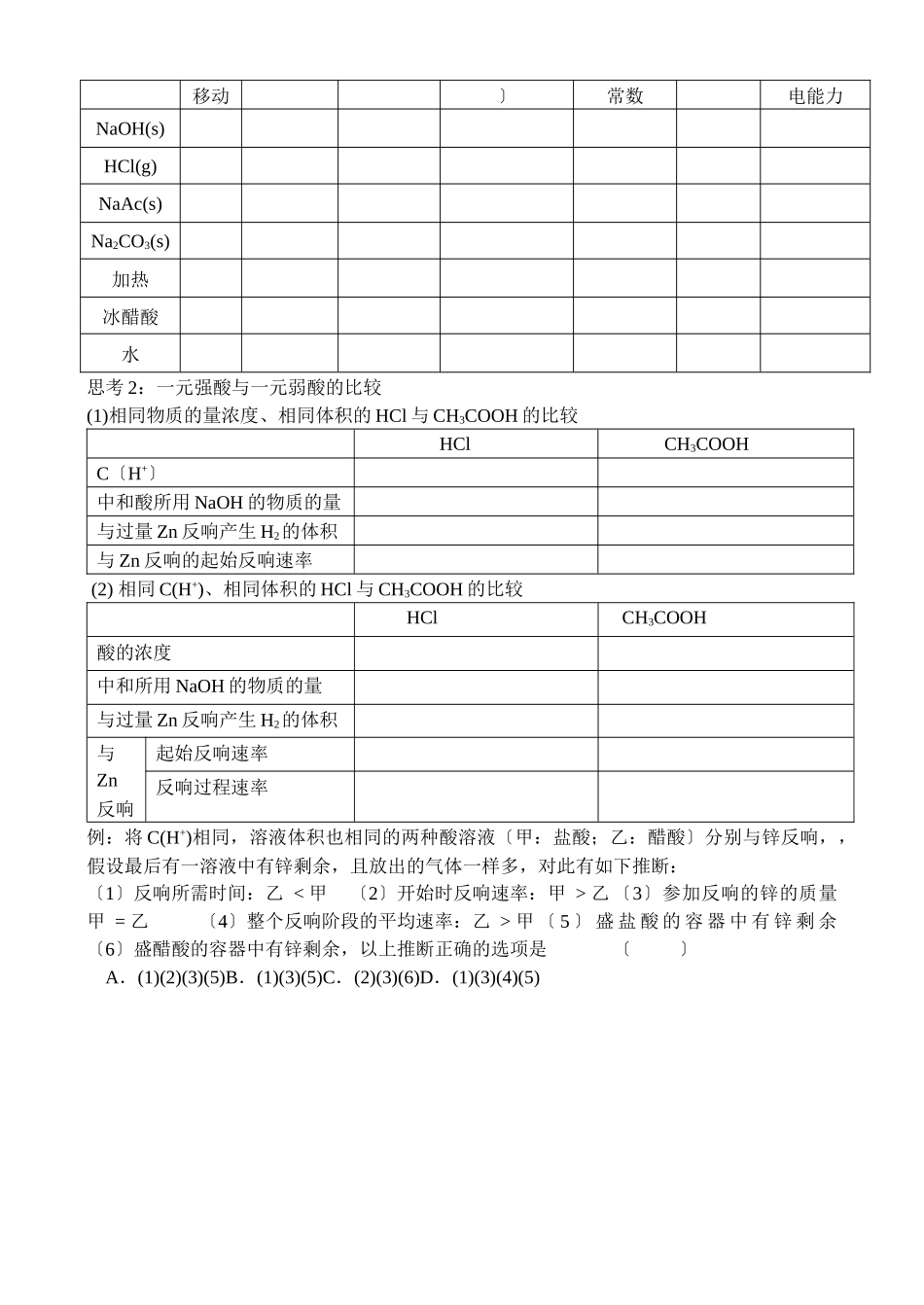
普通高中课程标准实验教科书--化学选修 4[江苏版]第一单元 弱电解质的电离平衡教案 15〔3-1-1:弱电解质的电离平衡〕【学习目标】1.掌握电解质的强弱与导电性强弱的区别。2.理解弱电解质电离平衡的建立和电离平衡的特征;3.掌握影响电离平衡移动的因素;4.掌握电离平衡常数和电离度的概念,并能用平衡常数讨论弱电解质的电离平衡。【学习重难点】影响电离平衡移动的因素、电离平衡常数【学习过程】回忆复习 强电解质〔概念:〕 电解质化合物〔概念:〕 弱电解质〔概念:〕纯洁物 非电解质〔概念:〕 单质混合物注:1、无论是电解质还是非电解质都必须是化合物;2、电解质必须是本身能电离出离子;3、电解质溶液的导电能力由自由移动的离子的浓度与离子所带的电荷数决定,与电解质的强弱无关。例 1 以下物质:a、氨水 b、液态 HCl c、Fe d、固体 BaSO4 e、冰醋酸f 、 SO2 g、Na2O h、CO2I、NH3 j、NaCl 固体k、KOH 溶液l、蔗糖其中能导电的有,属于电解质的有,属于非电解质的有,属于强电解质的有,属于弱电解质的有。一、强电解质和弱电解质的比较强电解质弱电解质共同特点电离程度电离过程〔是否可逆〕溶质微粒化合物类型物质类别强酸: 强碱: 弱酸: 绝大多数盐: 弱碱: 水注:难溶盐〔如:BaSO4、AgCl、CaCO3等〕一般是强电解质,尽管难溶,但溶于水的那局部是完全电离的。而许多难溶性碱〔如 Al〔OH〕3〕却是弱电解质。例 2 按要求书写以下物质的电离方程式: 〔1〕 CH3COOHNH3•H2OH2CO3 H2SO4〔2〕NaHSO4① 溶液中② 熔化时NaHCO3① 溶液中② 熔化时二、弱电解质电离平衡的建立在一定条件下〔如:温度、压强〕,当弱电解质电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就到达了平衡状态,这叫做电离平衡。三、电离平衡的特征 电离平衡是化学平衡的一种,因此同样具有“〞、“〞、“〞、“〞的特征。四、电离平衡常数和电离度1.电离平衡常数是指在一定条件下,弱电解质在溶液中到达平衡时,溶液中电离所生成的各种离子浓度的乘积与溶液中未电离的分子浓度的比值。 HA H+ + A-注:〔1〕在此计算公式中,离子浓度都是平衡浓度;〔2〕电离平衡常数的数值与温度有关,与浓度无关;弱电解质的电离是吸热的,一般温度越高,电离平衡常数越〔填“大〞或“小〞〕;〔3〕电离平衡常数反映弱电解质的相对强弱,通常用 Ka表示弱酸的电离平衡常数,用Kb表示弱碱的电离平衡常数。Ka越...