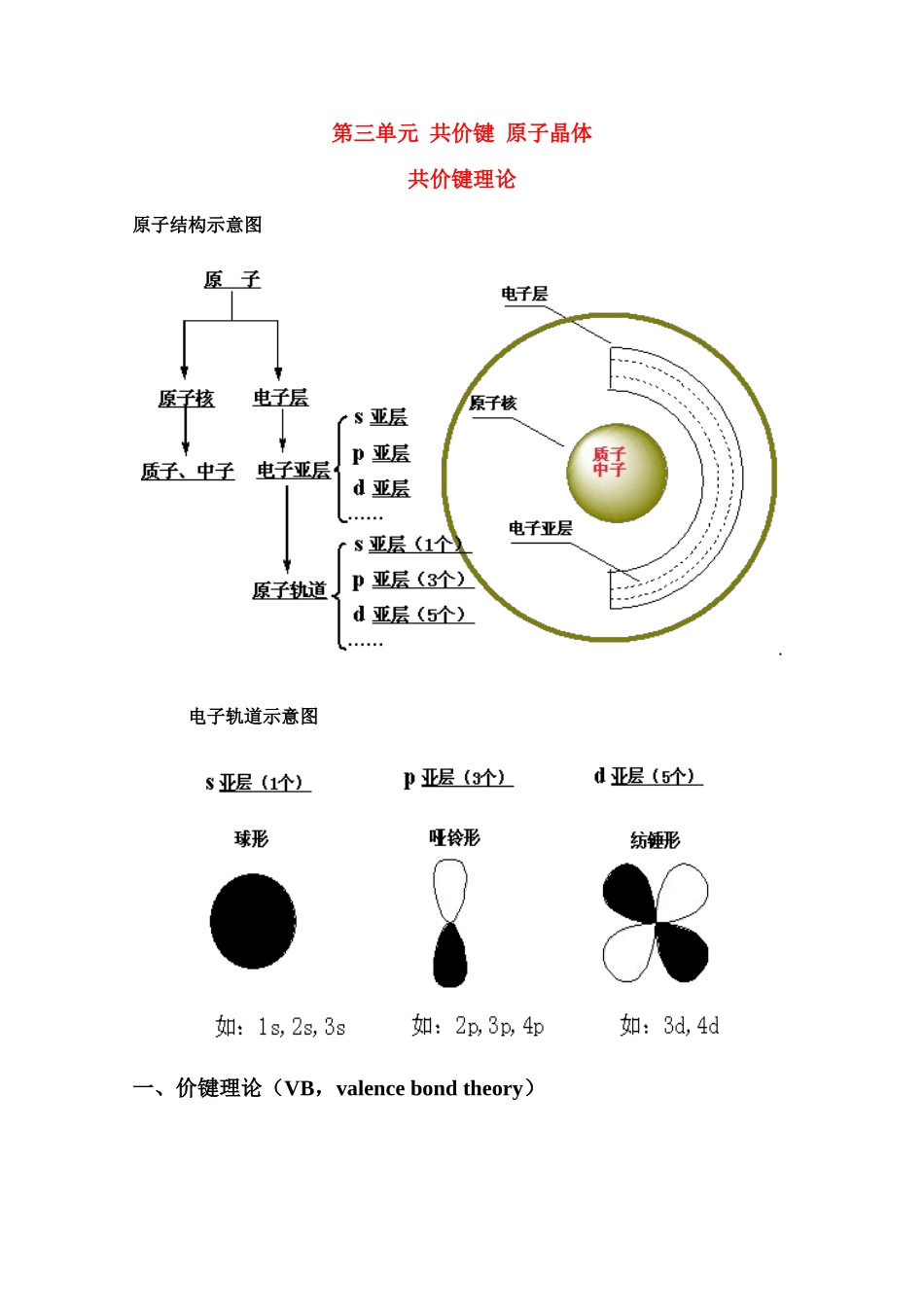
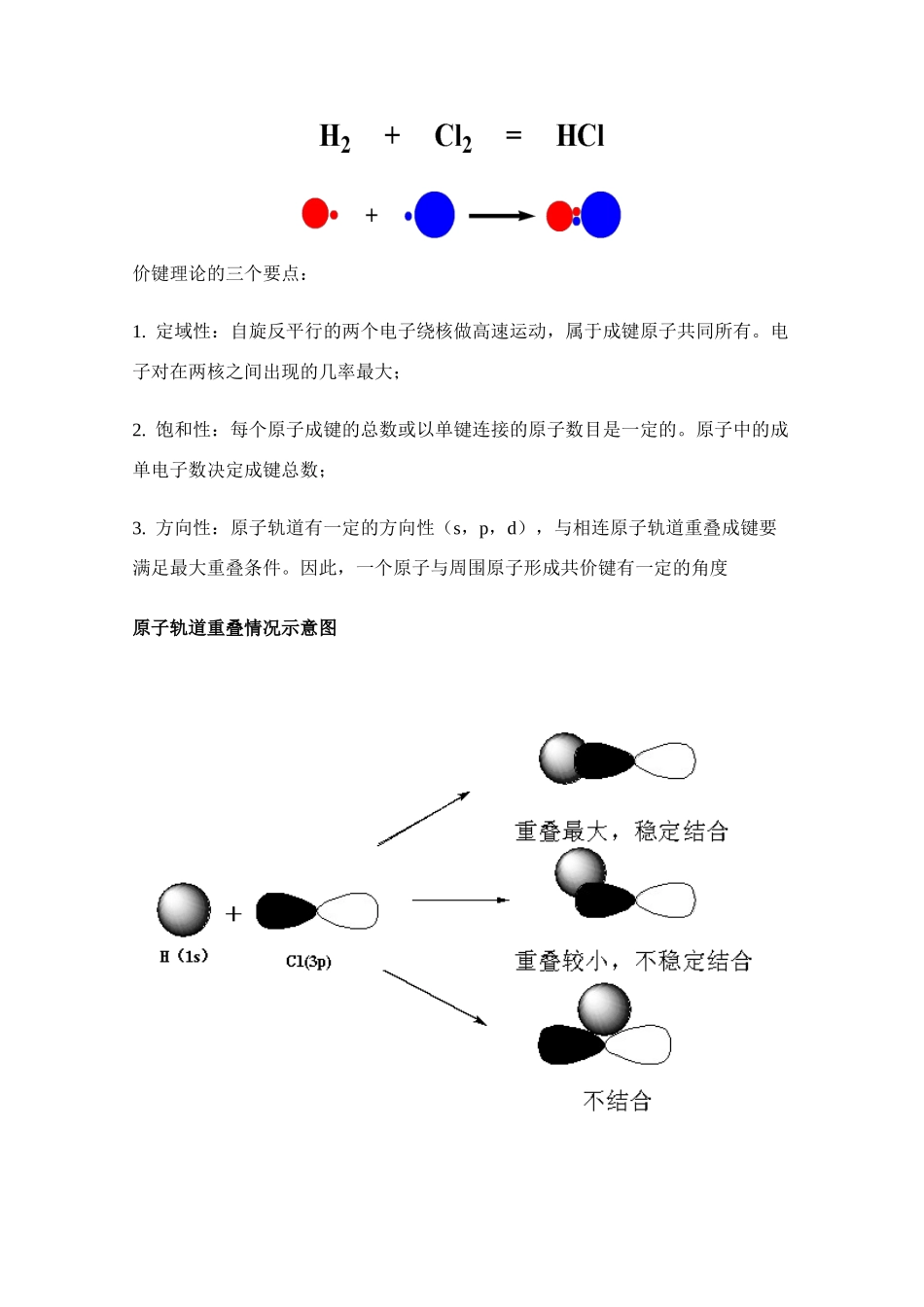
第三单元 共价键 原子晶体共价键理论原子结构示意图.电子轨道示意图 一、价键理论(VB,valence bond theory) 价键理论的三个要点:1. 定域性:自旋反平行的两个电子绕核做高速运动,属于成键原子共同所有。电子对在两核之间出现的几率最大;2. 饱和性:每个原子成键的总数或以单键连接的原子数目是一定的。原子中的成单电子数决定成键总数;3. 方向性:原子轨道有一定的方向性(s,p,d),与相连原子轨道重叠成键要满足最大重叠条件。因此,一个原子与周围原子形成共价键有一定的角度 原子轨道重叠情况示意图 成键方向对分子结构的影响 二、杂化轨道理论(hybrid orbital theory)1931 年,鲍林(Pauling L)提出原子轨道杂化理论。碳原子轨道的这种转化过程成为碳原子的杂化。1. 杂化与杂化轨道:杂化是指在形成分子时,由于原子间的相互影响,若干不同类型而能量相近的原子轨道混合起来,重新组合成一组新轨道的过程。所形成的新轨道称为杂化轨道。2. 孤立的原子不可能发生杂化,只有在形成分子的过程中才会发生。3. 在杂化前后,原子轨道的数目保持不变。4. 条件不同,杂化轨道类型可能不同。5. 碳原子的杂化:(1)sp3 杂化:原子轨道在杂化过程中经过一个激发态 这是用一个 2s 轨道和三个 2p 轨道进行的杂化,故称为 sp3 杂化。与基态轨道相比,杂化轨道具有以下特点: a). 能量相等,成分相同(1/4s 轨道和 3/4p 轨道); b). 杂化轨道的电子云分布更集中,可使成键轨道间的重叠部分增大,成键能力增强; c). sp3 杂化轨道在空间尽量伸展,呈最稳定正四面体型,轨道夹角 109°28′。 sp3 杂化又称为正四面体杂化。(2)sp2 杂化:由 2s 轨道核两个 2p 轨道杂化,形成三个等同的 sp2 杂化轨道。另有一个 2p 轨道不参与杂化。 a)杂化轨道成分:1/3s 轨道和 2/3p 轨道;b)成键能力较 sp3 杂化轨道弱,但较未杂化轨道强; c)杂化轨道呈平面三角形,夹角 120°。未杂化 2p 轨道垂直于这一平面。 (3)sp 杂化由 2s 轨道核一个 2p 轨道杂化,形成两个等同的 sp 杂化轨道。另有两个 2p 轨道不参与杂化。 a)杂化轨道成分:1/2s 轨道和 1/2p 轨道; b)成键能力较 sp2 杂化轨道弱,但较未杂化轨道强; c)杂化轨道呈直线型,夹角 180°。另两个未杂化 2p 轨道与这一直线两两垂直。三、σ 键和 π共价键具有方向性。按照成键的方向不同,分为 σ 键和 π 键。 σ...