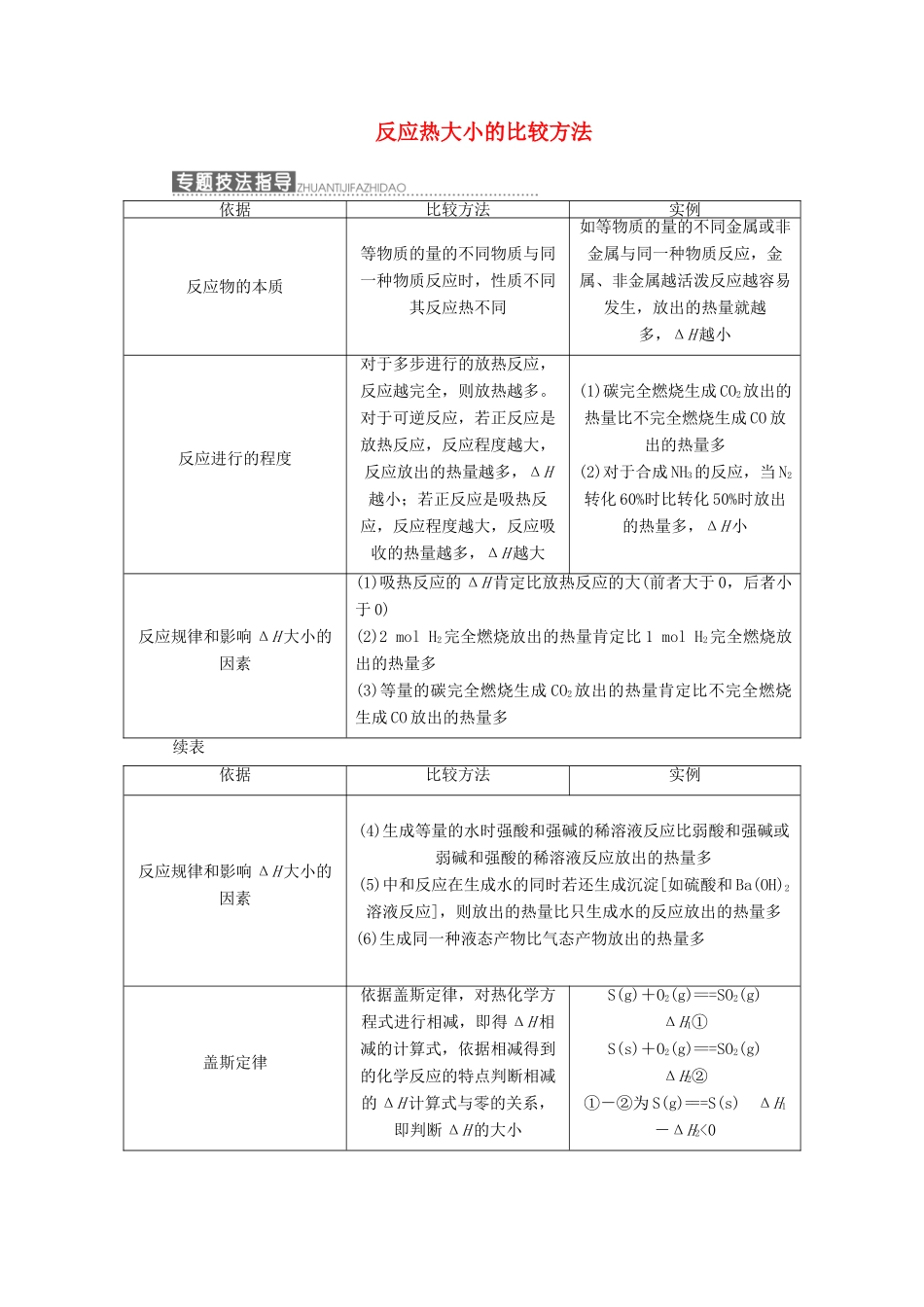
反应热大小的比较方法依据比较方法实例反应物的本质等物质的量的不同物质与同一种物质反应时,性质不同其反应热不同如等物质的量的不同金属或非金属与同一种物质反应,金属、非金属越活泼反应越容易发生,放出的热量就越多,ΔH越小反应进行的程度对于多步进行的放热反应,反应越完全,则放热越多。对于可逆反应,若正反应是放热反应,反应程度越大,反应放出的热量越多,ΔH越小;若正反应是吸热反应,反应程度越大,反应吸收的热量越多,ΔH越大(1)碳完全燃烧生成CO2放出的热量比不完全燃烧生成CO放出的热量多(2)对于合成NH3的反应,当N2转化60%时比转化50%时放出的热量多,ΔH小反应规律和影响ΔH大小的因素(1)吸热反应的ΔH肯定比放热反应的大(前者大于0,后者小于0)(2)2molH2完全燃烧放出的热量肯定比1molH2完全燃烧放出的热量多(3)等量的碳完全燃烧生成CO2放出的热量肯定比不完全燃烧生成CO放出的热量多续表依据比较方法实例反应规律和影响ΔH大小的因素(4)生成等量的水时强酸和强碱的稀溶液反应比弱酸和强碱或弱碱和强酸的稀溶液反应放出的热量多(5)中和反应在生成水的同时若还生成沉淀[如硫酸和Ba(OH)2溶液反应],则放出的热量比只生成水的反应放出的热量多(6)生成同一种液态产物比气态产物放出的热量多盖斯定律依据盖斯定律,对热化学方程式进行相减,即得ΔH相减的计算式,依据相减得到的化学反应的特点判断相减的ΔH计算式与零的关系,即判断ΔH的大小S(g)+O2(g)===SO2(g)ΔH1①S(s)+O2(g)===SO2(g)ΔH2②①-②为S(g)===S(s)ΔH1-ΔH2<01.根据下列热化学方程式可判断ΔH1、ΔH2、ΔH3三者的大小关系是()2H2(g)+O2(g)===2H2O(l)ΔH12H2(g)+O2(g)===2H2O(g)ΔH2H2(g)+O2(g)===H2O(g)ΔH3A.ΔH3>ΔH2>ΔH1B.ΔH1>ΔH2>ΔH3C.ΔH1=ΔH2>ΔH3D.ΔH2<ΔH1<ΔH3解析:选A当H2O为液态时放热多,再结合反应H2物质的量可知:ΔH3>ΔH2>ΔH1,A正确。2.奥运会火炬使用的燃料是丙烷(C3H8),其完全燃烧后只有CO2和H2O,不会造成环境污染,已知有以下四个热化学反应方程式:①C3H8(g)+5O2(g)===3CO2(g)+4H2O(g)ΔH=-akJ·mol-1②C3H8(g)+5O2(g)===3CO2(g)+4H2O(l)ΔH=-bkJ·mol-1③2C3H8(g)+9O2(g)===4CO2(g)+2CO(g)+8H2O(l)ΔH=-ckJ·mol-1④C3H8(g)+O2(g)===CO2(g)+2H2O(g)ΔH=-dkJ·mol-1其中a、b、c、d最大的是()A.aB.bC.cD.d解析:选C①与②相比生成液态水比气态水放出的热量多,所以b>a,④中各物质的量均为①中的一半,所以d=a,③中与②相比,2molC3H8燃烧生成4molCO2和2molCO,相当于此反应中的2molC3H8有1mol完全燃烧,1mol不完全燃烧,故放出的热量c大于b,所以c最大,选C。3.下列各组热化学方程式中,化学反应的ΔH前者大于后者的是()①C(s)+O2(g)===CO2(g)ΔH1C(s)+1/2O2(g)===CO(g)ΔH2②S(s)+O2(g)===SO2(g)ΔH3S(g)+O2(g)===SO2(g)ΔH4③H2(g)+1/2O2(g)===H2O(l)ΔH52H2(g)+O2(g)===2H2O(l)ΔH6④CaCO3(s)===CaO(s)+CO2(g)ΔH7CaO(s)+H2O(l)===Ca(OH)2(s)ΔH8A.①③④B.④C.②③④D.②④解析:选C从热化学方程式与化学方程式的区别、ΔH大小的比较进行分析。碳与氧气反应放热,即ΔH1<0,ΔH2<0,CO再与O2反应时又放热,前者放出热量多,所以ΔH1<ΔH2;等量的固态硫变为气态硫蒸气时吸收热量,故在与O2反应时产生等量的SO2时,气态硫放出的热量多,即ΔH3>ΔH4;发生同样的燃烧反应,物质的量越多,放出的热量越多,故ΔH5>ΔH6;碳酸钙分解吸收热量,ΔH7>0,CaO与H2O反应放出热量,ΔH8<0,显然ΔH7>ΔH8。