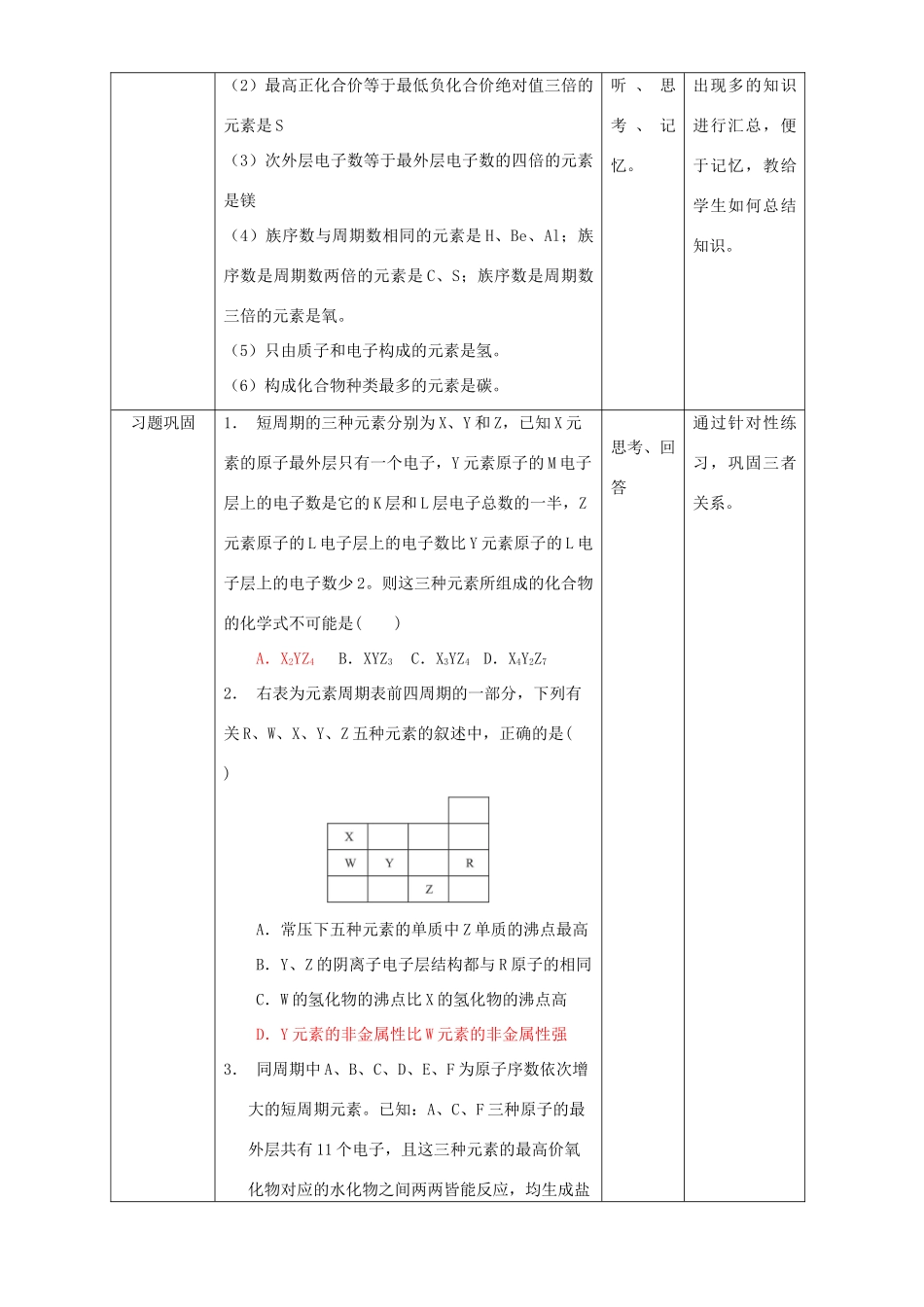
“位一构一性”综合运用课题1-2-3专题:“位一构一性”综合运用教学目标知识与技能1、了解元素“位、构、性”三者间的关系,初步学会运用元素周期表。2、掌握元素周期律、运用元素周期律。过程与方法通过对本节内容的整体学习,学会运用元素周期律和元素周期表指导探究化学知识的学习方法。情感、态度与价值观通过对元素“位、构、性”间关系的学习,帮助学生初步树立“事物的普遍联系”等辩证唯物主义观点。教学重点元素周期律的运用教学难点元素“位、构、性”三者间的关系。教学设计环节教师活动学生活动设计意图导入新课今天我们就元素周期表中“位、构、性”三者关系的应用,进行专题训练。学生直接知道这节课所学内容。直接进入主题,让学生了解这节课的目的。组内讨论归纳原子结构和周期表位置的关系【过渡】元素周期律的实质:元素性质的周期性变化是元素原子的核外电子排布周期性变化的必然结果。【板书】一、原子结构和周期表位置【小组讨论】根据学过知识,原子结构和周期表位置之间有什么关系呢?【讲述】这个问题需要从原子核外电子排布上入手:质子数=原子序数=核电荷数,电子层数=周期数,最外层电子数=族序数(主族),主族元素的最高正价=族序数,最低负价=主族序数-8。【板书】1.原子结构决定思考,小组内讨论,代表回答。通过学生对已学知识的回忆、归纳,把零散知识进行系统化,便于掌握。培养学生的总结归纳能力。周期表位置2.四个关系式:电子层数=周期数,最外层电子数=族序数(主族),主族元素的最高正价=族序数,最低负价=主族序数-8。组内讨论原子结构和元素性质的关系【小组讨论】根据上述分析,原子结构和元素(单质)性质有哪些关系呢?【板书】二、原子结构和元素(单质)性质的关系1.决定2.最外层电子数越多,越容易得到电子,非金属性越强;最外层电子数越少,越容易失去电子,金属性就越强;原子半径越大,对最外层电子的吸引力越小,越容易失去电子,即金属性越强;同理,半径越小,非金属性越强。思考、讨论,代表回答,其他同学补充根据上述分析问题的过程,让学生自己推导原子结构和元素性质的关系,培养学生对知识的学以致用的能力。组内讨论周期表的位置和元素性质的关系【过渡】根据前两个关系的确定,我们直接确定它们的关系?【板书】三、周期表位置和元素性质的关系1.反映2.同周期:自左向右,非金属性增强,同主族:自上而下,金属性增强金属元素位于周期表的左下部,越往左下角,金属性越强非金属位于周期表的右上部,越靠近右上角,非金属性越强。思考、讨论,代表回答,其他同学补充前两个关系已经说明,同学直接说明关系。知识迁移(1)周期序数等于族序数两倍的元素是Li学生聆把平时做题中构位决定反推原子结构元素(单质)性质构性决定反推周期表位置元素性质位性反映(2)最高正化合价等于最低负化合价绝对值三倍的元素是S(3)次外层电子数等于最外层电子数的四倍的元素是镁(4)族序数与周期数相同的元素是H、Be、Al;族序数是周期数两倍的元素是C、S;族序数是周期数三倍的元素是氧。(5)只由质子和电子构成的元素是氢。(6)构成化合物种类最多的元素是碳。听、思考、记忆。出现多的知识进行汇总,便于记忆,教给学生如何总结知识。习题巩固1.短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上的电子数少2。则这三种元素所组成的化合物的化学式不可能是()A.X2YZ4B.XYZ3C.X3YZ4D.X4Y2Z72.右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是()A.常压下五种元素的单质中Z单质的沸点最高B.Y、Z的阴离子电子层结构都与R原子的相同C.W的氢化物的沸点比X的氢化物的沸点高D.Y元素的非金属性比W元素的非金属性强3.同周期中A、B、C、D、E、F为原子序数依次增大的短周期元素。已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应,均生成盐思考、回答通过针对性练习,巩固三者关系。和水...