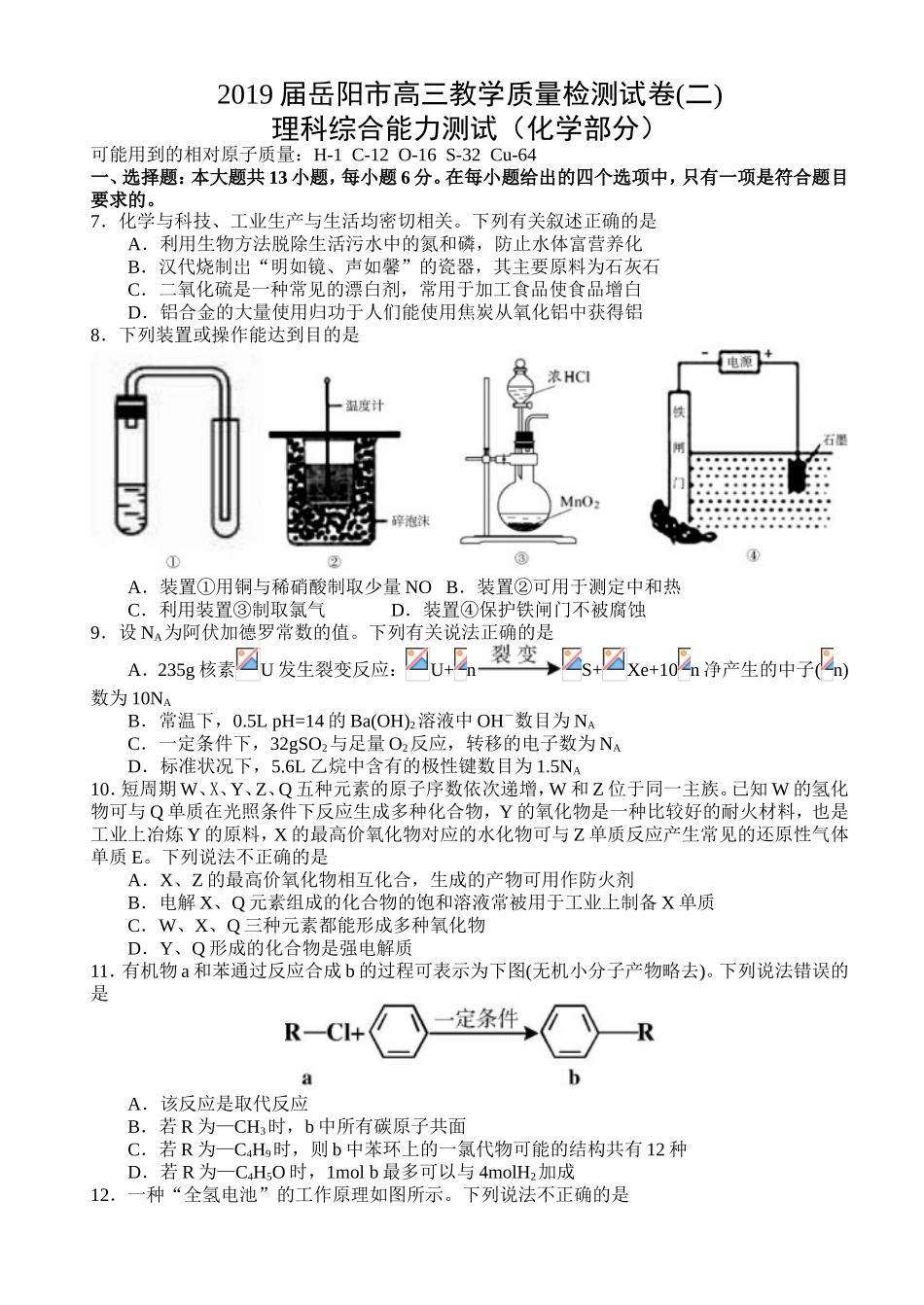
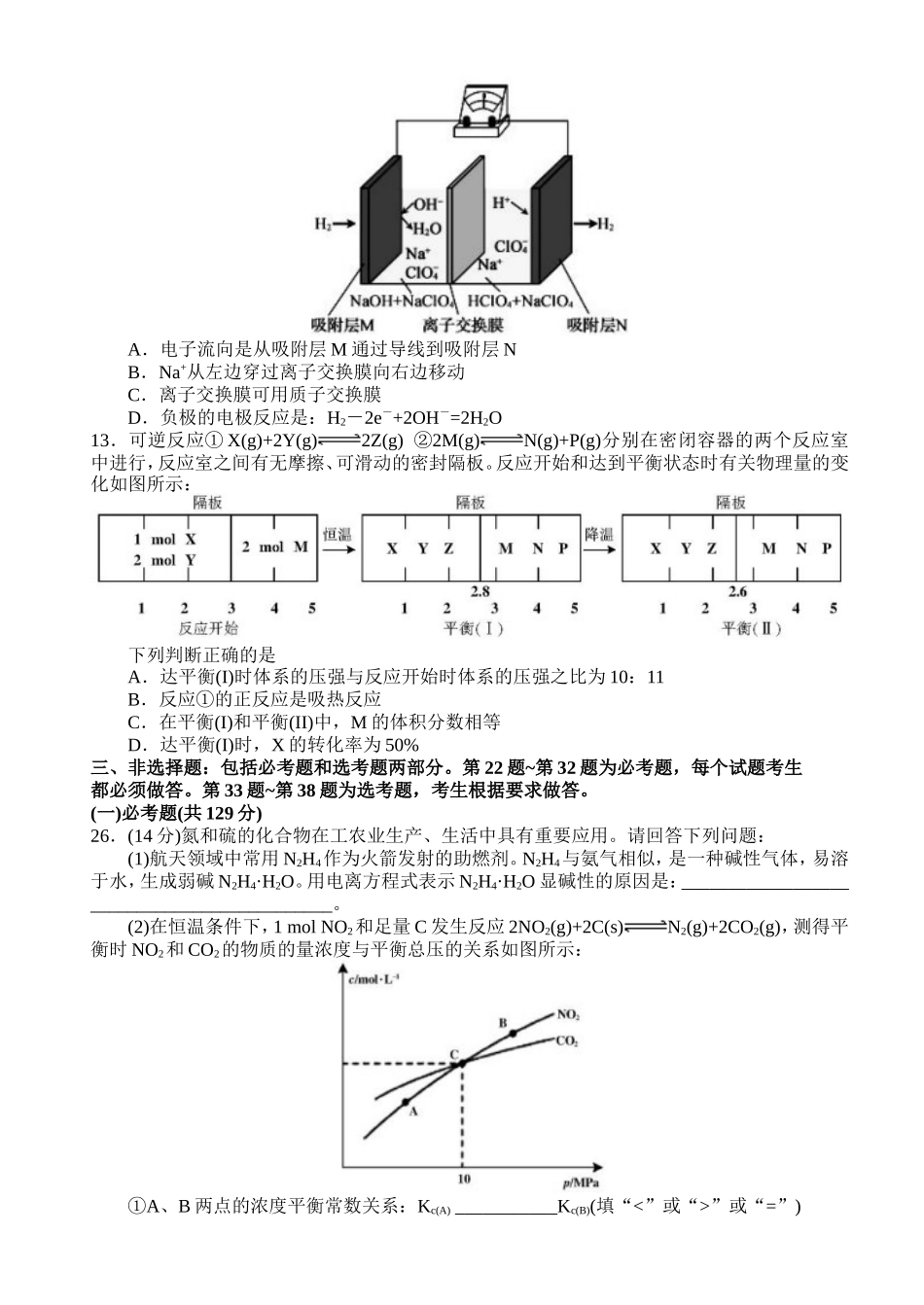
2019届岳阳市高三教学质量检测试卷(二)理科综合能力测试(化学部分)可能用到的相对原子质量:H-1C-12O-16S-32Cu-64一、选择题:本大题共13小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。7.化学与科技、工业生产与生活均密切相关。下列有关叙述正确的是A.利用生物方法脱除生活污水中的氮和磷,防止水体富营养化B.汉代烧制岀“明如镜、声如馨”的瓷器,其主要原料为石灰石C.二氧化硫是一种常见的漂白剂,常用于加工食品使食品增白D.铝合金的大量使用归功于人们能使用焦炭从氧化铝中获得铝8.下列装置或操作能达到目的是A.装置①用铜与稀硝酸制取少量NOB.装置②可用于测定中和热C.利用装置③制取氯气D.装置④保护铁闸门不被腐蚀9.设NA为阿伏加德罗常数的值。下列有关说法正确的是A.235g核素U发生裂变反应:U+nS+Xe+10n净产生的中子(n)数为10NAB.常温下,0.5LpH=14的Ba(OH)2溶液中OH-数目为NAC.一定条件下,32gSO2与足量O2反应,转移的电子数为NAD.标准状况下,5.6L乙烷中含有的极性键数目为1.5NA10.短周期W、X、Y、Z、Q五种元素的原子序数依次递增,W和Z位于同一主族。已知W的氢化物可与Q单质在光照条件下反应生成多种化合物,Y的氧化物是一种比较好的耐火材料,也是工业上冶炼Y的原料,X的最高价氧化物对应的水化物可与Z单质反应产生常见的还原性气体单质E。下列说法不正确的是A.X、Z的最高价氧化物相互化合,生成的产物可用作防火剂B.电解X、Q元素组成的化合物的饱和溶液常被用于工业上制备X单质C.W、X、Q三种元素都能形成多种氧化物D.Y、Q形成的化合物是强电解质11.有机物a和苯通过反应合成b的过程可表示为下图(无机小分子产物略去)。下列说法错误的是A.该反应是取代反应B.若R为—CH3时,b中所有碳原子共面C.若R为—C4H9时,则b中苯环上的一氯代物可能的结构共有12种D.若R为—C4H5O时,1molb最多可以与4molH2加成12.一种“全氢电池”的工作原理如图所示。下列说法不正确的是A.电子流向是从吸附层M通过导线到吸附层NB.Na+从左边穿过离子交换膜向右边移动C.离子交换膜可用质子交换膜D.负极的电极反应是:H2-2e-+2OH-=2H2O13.可逆反应①X(g)+2Y(g)2Z(g)②2M(g)N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:下列判断正确的是A.达平衡(I)时体系的压强与反应开始时体系的压强之比为10:11B.反应①的正反应是吸热反应C.在平衡(I)和平衡(II)中,M的体积分数相等D.达平衡(I)时,X的转化率为50%三、非选择题:包括必考题和选考题两部分。第22题~第32题为必考题,每个试题考生都必须做答。第33题~第38题为选考题,考生根据要求做答。(一)必考题(共129分)26.(14分)氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:(1)航天领域中常用N2H4作为火箭发射的助燃剂。N2H4与氨气相似,是一种碱性气体,易溶于水,生成弱碱N2H4·H2O。用电离方程式表示N2H4·H2O显碱性的原因是:____________________________________________。(2)在恒温条件下,1molNO2和足量C发生反应2NO2(g)+2C(s)N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:①A、B两点的浓度平衡常数关系:Kc(A)___________Kc(B)(填“<”或“>”或“=”)②A、B、C三点中NO2的转化率最高的是___________(填“A”或“B”或“C”)点。③计算C点时该反应的压强平衡常数Kp=___________MPa(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。(3)已知:亚硝酸(HNO2)性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数Ka=5.1×10-4;H2CO3的Ka1=4.2×10-7,Ka2=5.61×10-11。在常温下向含有2mol碳酸钠的溶液中加入1mol的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小的顺序是______________________。(4)已知:常温下甲胺(CH3NH2)的电离常数为Kb,且pKb=-lgKb=3.4水溶液中有CH3NH2+H2OCH3NH3++OH-。常温下向CH3NH2溶液滴加稀硫酸至c(CH3NH2)=c(CH3NH3+)时,则溶液pH=___________。(5)一种煤炭脱硫技...