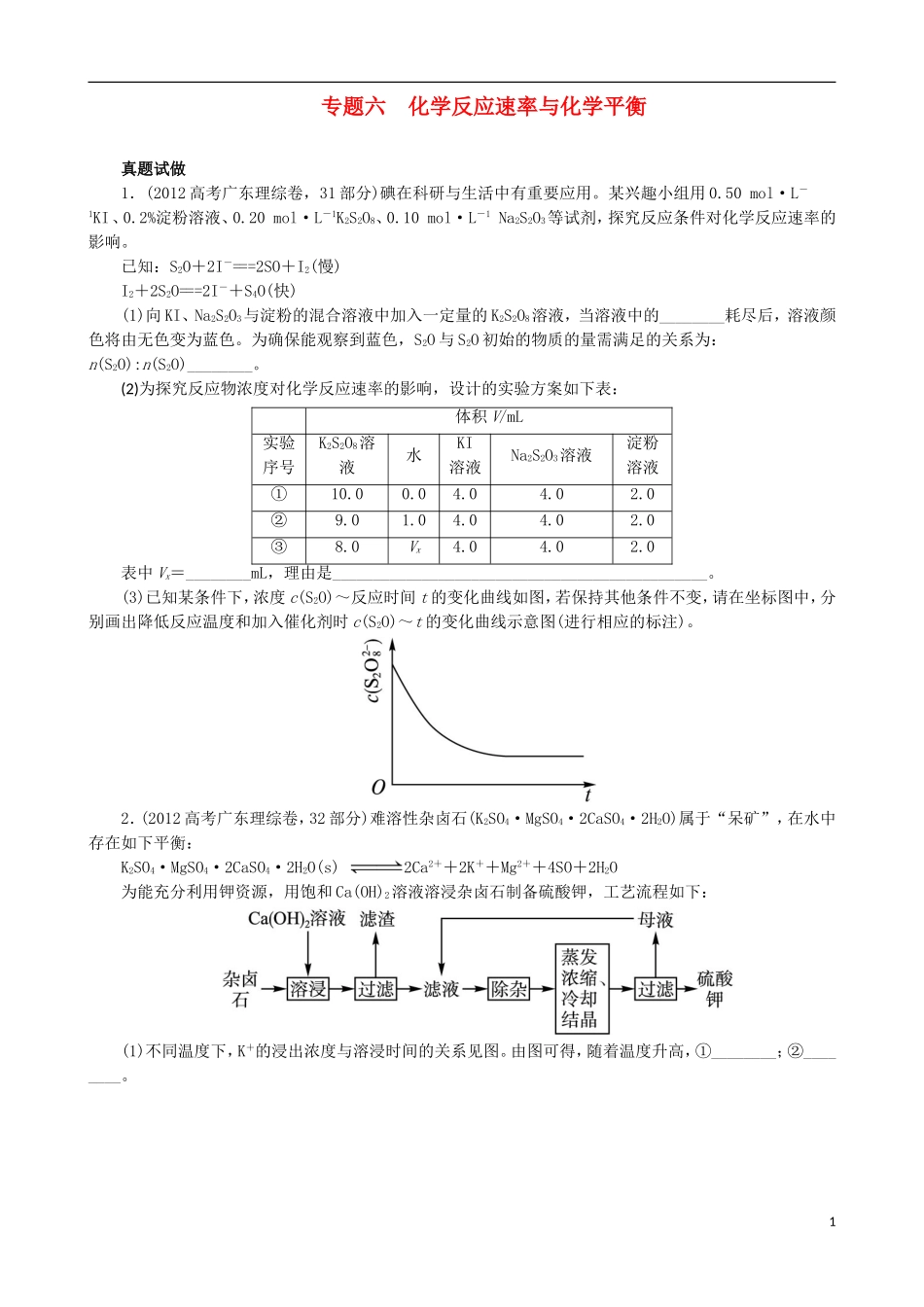
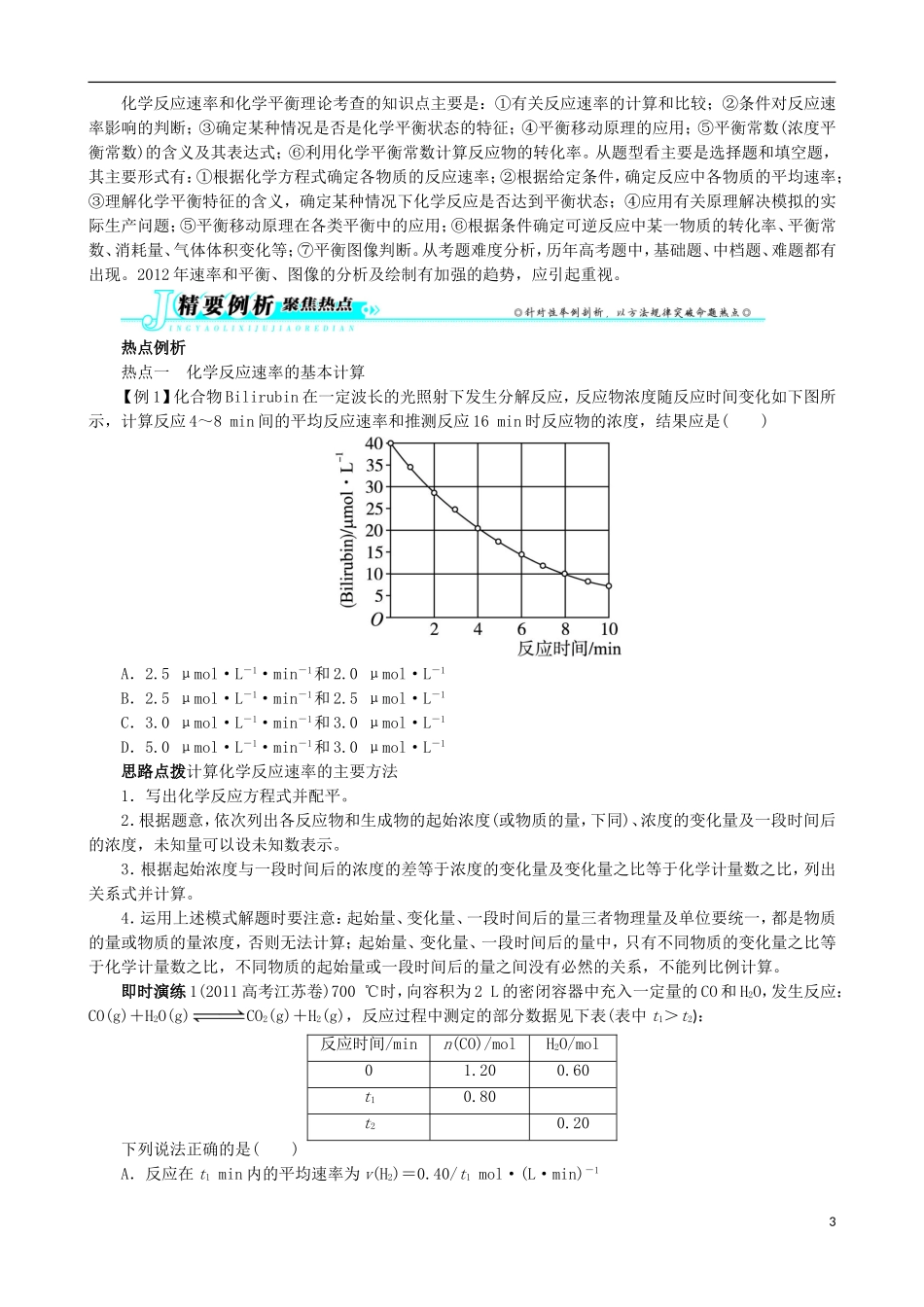
专题六化学反应速率与化学平衡真题试做1.(2012高考广东理综卷,31部分)碘在科研与生活中有重要应用。某兴趣小组用0.50mol·L-1KI、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。已知:S2O+2I-===2SO+I2(慢)I2+2S2O===2I-+S4O(快)(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的________耗尽后,溶液颜色将由无色变为蓝色。为确保能观察到蓝色,S2O与S2O初始的物质的量需满足的关系为:n(S2O):n(S2O)________。(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:体积V/mL实验序号K2S2O8溶液水KI溶液Na2S2O3溶液淀粉溶液①10.00.04.04.02.0②9.01.04.04.02.0③8.0Vx4.04.02.0表中Vx=________mL,理由是______________________________________________。(3)已知某条件下,浓度c(S2O)~反应时间t的变化曲线如图,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时c(S2O)~t的变化曲线示意图(进行相应的标注)。2.(2012高考广东理综卷,32部分)难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:K2SO4·MgSO4·2CaSO4·2H2O(s)2Ca2++2K++Mg2++4SO+2H2O为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:(1)不同温度下,K+的浸出浓度与溶浸时间的关系见图。由图可得,随着温度升高,①________;②________。1(2)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+COCaCO3(s)+SO已知298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K(计算结果保留三位有效数字)。3.(2010高考广东理综卷部分,31)硼酸(H3BO3)在食品、医药领域应用广泛。(1)在其他条件相同时,反应H3BO3+3CH3OHB(OCH3)3+3H2O中,H3BO3的转化率(α)在不同温度下随反应时间(t)的变化如图所示,由此图可得出温度对该反应的反应速率和平衡移动的影响是__________________________。(2)H3BO3溶液中存在如下反应:H3BO3(aq)+H2O(l)[B(OH)4]-(aq)+H+(aq),已知0.70mol·L-1H3BO3溶液中,上述反应于298K达到平衡时,c平衡(H+)=2.0×10-5mol·L-1,c平衡(H3BO3)≈c起始(H3BO3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)。4.(2012高考海南卷,15)已知A(g)+B(g)C(g)+D(g)反应的平衡常数和温度的关系如下:温度/℃70090083010001200平衡常数1.71.11.00.60.4回答下列问题:(1)该反应的平衡常数表达式K=________,ΔH________0(填“<”“>”“=”);(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol·L-1·s-1,则6s时c(A)=________mol·L-1,C的物质的量为________mol;若反应经一段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为________;(3)判断该反应是否达到平衡的依据为________(填正确选项前的字母);a.压强不随时间改变b.气体的密度不随时间改变c.c(A)不随时问改变d.单位时间里生成C和D的物质的量相等(4)1200℃时反应C(g)+D(g)A(g)+B(g)的平衡常数的值为________。考向分析2化学反应速率和化学平衡理论考查的知识点主要是:①有关反应速率的计算和比较;②条件对反应速率影响的判断;③确定某种情况是否是化学平衡状态的特征;④平衡移动原理的应用;⑤平衡常数(浓度平衡常数)的含义及其表达式;⑥利用化学平衡常数计算反应物的转化率。从题型看主要是选择题和填空题,其主要形式有:①根据化学方程式确定各物质的反应速率;②根据给定条件,确定反应中各物质的平均速率;③理解化学平衡特征的含义,确定某种情况下化学反应是否达到平衡状态;④应用有关原理解决模拟的实际生产问题;⑤平衡移动原理在各类平衡中的应用;⑥根据条件确定可逆反应中某一物质的转化率、平衡常数、消耗量、气体体积变化等;⑦平衡图像判断。从考题难度分析,历年高考题中,基础题...