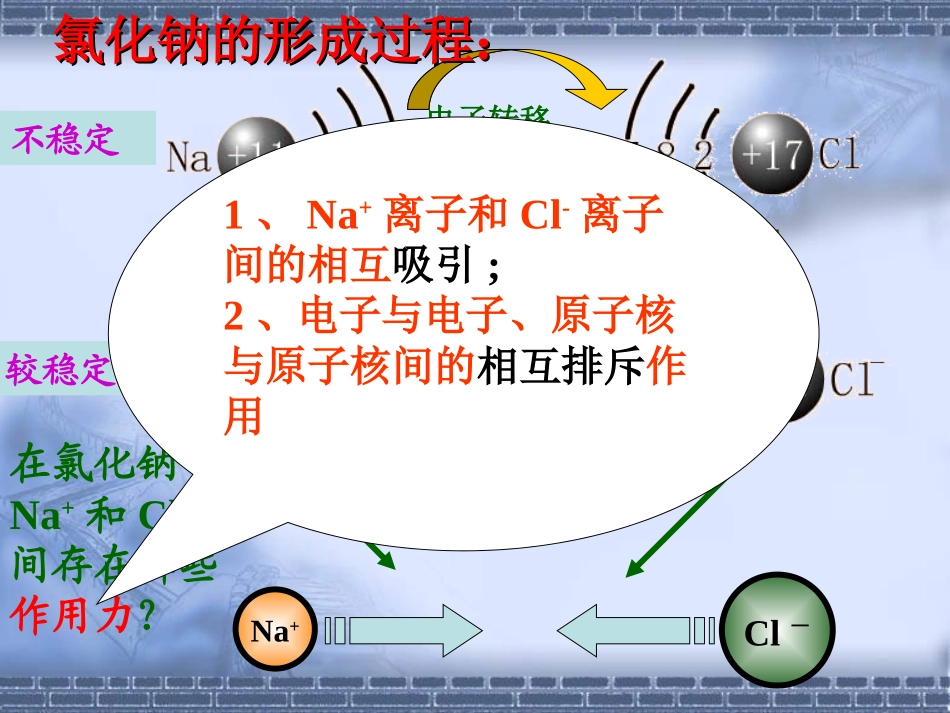
第一章物质结构元素周期律第三节化学键实验(1-2)现象钠在氯气中燃烧,产生黄色火焰,瓶中充满白烟2Na+Cl2==2NaCl运用核外电子排布的知识分析氯化钠的形成过程。Na+Cl-电子转移氯化钠的形成过程:氯化钠的形成过程:不稳定较稳定在氯化钠中Na+和Cl-间存在哪些作用力?1、Na+离子和Cl-离子间的相互吸引;2、电子与电子、原子核与原子核间的相互排斥作用一、离子键1.定义:带相反电荷离子之间的相互作用称为离子键。2.成键本质电子得失带相反电荷的离子静电作用(吸引和排斥)成键原因:成键粒子:作用力:思考思考哪些物质存在离子键?(2)活泼的金属元素和酸根离子形成的盐(3)铵盐(4)强碱(1)活泼金属元素(IA,IIA)和活泼非金属元素(VIA,VIIA)形成的化合物,如NaCl、Na2O等。3.存在:由离子构成的化合物练习1.下列物质中含有离子键的是()1、H2O2、CaCl23、NaOH4、H2SO45、Na2O6、CO27、Na2O28、NH4Cl2、3、5、7、82、CaCl23、NaOH5、Na2O7、Na2O28、NH4Cl4.离子化合物:由离子键构成的化合物。(强碱、大部分盐、活泼金属氧化物、金属过氧化物等)⑴.原子的电子式:HOClMgNa5.电子式:在元素符号周围用小黑点.(或×)来表示原子的最外层电子的式子。⑵.离子的电子式:①阴离子的电子式一般用表示Rn-ClO2-OH-②阳离子的电子式即离子符号如:Mg2NaH+NH+HHH.复杂⑶.离子化合物的电子式:由阳离子的电子式和阴离子的电子式组合而成.注意:相同的离子不能写在一起,一般对称排列如:Mg2BrBrMg2Br2×ClNaNaO2-NaClMg2ClS2-KKSKK例:⑷.用电子式表示离子化合物的形成过程左侧写原子的电子式,右侧写离子化合物的电子式,中间用连接.注意:用弧形箭头表示电子转移的方向.练习3.用电子式表示KCl的形成过程练习2.写出下列微粒的电子式:硫原子、溴原子、硫离子、铝离子布置作业1.完成《课本》----P24:习题1、2题