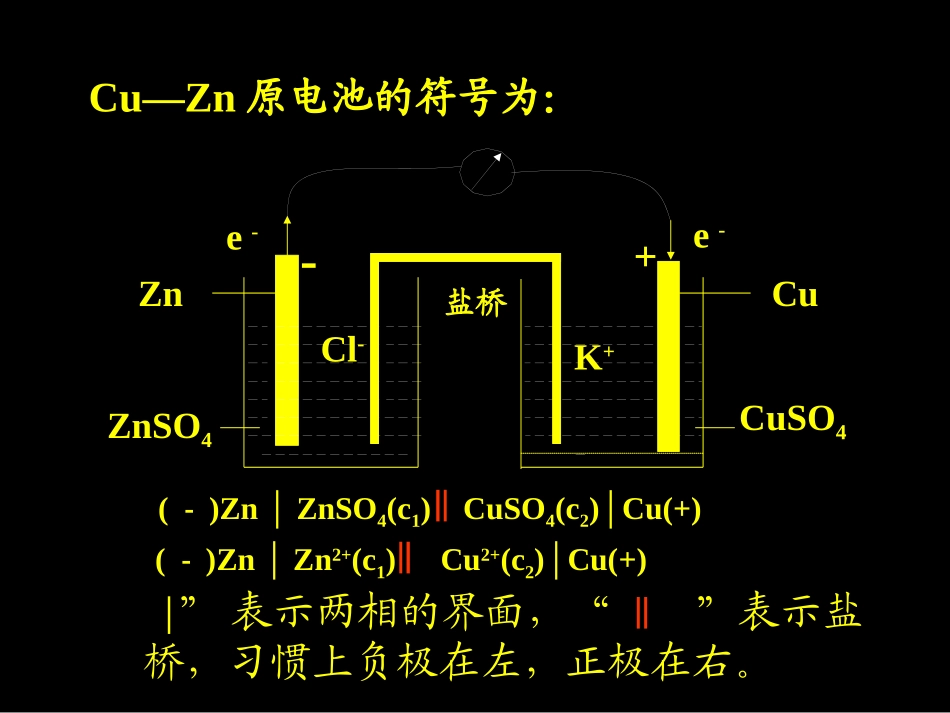
电极电势Cu–Zn原电池Cu2+(aq)+Zn(s)Zn2+(aq)+Cu(s)△H=-218.66kJ·mol-1+-ZnSO4CuSO4CuZnK+Cl-盐桥e-e-盐桥(饱和KCl溶液琼脂胶冻)的作用是中和溶液中过剩的电荷,沟通电路,保持两溶液的电中性,保证了Zn的氧化和Cu2+的还原继续进行。=Cu—Zn原电池的符号为:(-)Zn│ZnSO4(c1)CuSO4(c2)│Cu(+)“│”表示两相的界面,“”表示盐桥,习惯上负极在左,正极在右。+-ZnSO4CuSO4CuZnK+Cl-盐桥e-e-(-)Zn│Zn2+(c1)Cu2+(c2)│Cu(+)4若组成电极物质中无金属时,应插入惰性电极。(-)PtFe∣3+(c1),Fe2+(c2)Cl-(c3)∣Cl2(p),Pt(+)2Fe2+(aq)+Cl2(g)=2Fe3+(aq)+2Cl-(aq)电极中含有不同氧化态同种离子时,高氧化态离子靠近盐桥,低氧化态离子靠近电极,中间用“,”分开。Sn4+(c1),Sn2+(c2)|Pt(+)5气体物质应靠近电极,后面应注明压力。中间用“,”分开气体物质和电极。(-)Zn|Zn2+(c1)H+(c1)|H2(p),Pt(+)电池符号的书写规则1、负极写左边,正极写右边;2.以化学式表示电池中各物质的组成,溶液要标浓度(mol·L-1),气体物质应注明其分压(Pa),还应标明当时的温度。如不写,则温度为298.15K,气体分压为101.325kPa,溶液浓度为1mol·L-1。3.以符号“∣”表示不同相之间的界面,用“‖”表示盐桥。同一相中的不同物质之间用“,”隔开。4.当无金属参与反应,用惰性电极Pt或C做电极。Cl2+2I-=2Cl-+I2Fe(s)+Cu2+(aq)=Cu(s)+Fe2+(aq)c(Cu2+)=1mol/Lc(Fe2+)=1mol/L电池符号:电池符号:(-)Fe(s)∣Fe2+(1mol/L)‖Cu2+(1mol/L)∣Cu(s)(+)负极:Fe(s)-2e=Fe2+(aq)正极:Cu2+(aq)+2e=Cu(s)负极:2I-=I2+2e-(氧化反应)正极:Cl2+2e-=2Cl-(还原反应)电池符号为:(-)Pt∣I2(s)∣I-(c)‖Cl-(c)∣Cl2(P)∣Pt(+)每个半电池由金属(或石墨)和电解质溶液组成,其中必须同时存在某一物质的氧化态和还原态。氧化态物质与其还原态构成电对。每一个电对产生氧化或还原反应(半电池反应),每两个电对产生氧化还原反应(原电池反应)。电对简记为:氧化态|还原态(或氧化态/还原态)。氧化态要写在前面。如锌与硫酸锌溶液铜与硫酸铜溶液简记为Zn2+|ZnCu2+|Cu氧化还原电对及其种类电对:氧化态/还原态如Zn2+/ZnCu2+/Cu金属同金属离子间Zn2+/ZnZn2+(C)Zn(+)(-)ZnZn2+(C)Zn2++2e-Zn中性分子同相应离子间H+/H22H++2e-H2H+(C)H2(P)Pt(+)(-)PtH2(P)H+(C)金属同金属难溶盐间AgCl/AgAgCl+e-Cl-+Ag同一元素不同价态间Fe3+/Fe2+Fe3+(C),Fe2+(C)Pt(+)(-)PtFe3+(C),Fe2+(C)Fe3++e-Fe2+Cl-(C)AgClAg(+)(-)AgAgClCl-(C)种类电对电极符号电极反应一、电池电动势的产生机理将金属片插入水中,晶格中的金属离子将与水分子发生水合作用,而溶入水相,使金属表面带负电,而液相带正电,在固液界面上形成双电层结构。金属------------++++++++++++紧密层:厚度约为10-10m,因静电吸引而形成;双电层结构示意图紧密层扩散层:厚度约10-10m~10-6m,因离子的热运动而形成。扩散层金属-溶液界面上双电层的存在,阻止了金属离子进一步向溶液中的溶入或向电极表面的沉积,最后达成平衡,形成电势差。溶解沉积M(s)+mH2O(l)[M(H2O)m]n++ne-++++++++--------双电层--------++++++++如果将金属浸入含有该金属离子的水溶液中,在固液界面处也将形成双电层,只是当溶液中的金属离子更容易获得电子时,金属表面带正电,而液相带负电。a.不同电极由于沉积和溶解速率不同,电极电势也不同。b.电极电势与温度、浓度有关。c.电极电势反映物质在水溶液中得失电子的能力。金属越活泼,失电子能力越强,电极电势越小。金属越不活泼,失电子能力越弱,电极电势越大。一、电极电势1.电极电势():产生与金属表面与其盐溶液双电层之间的电势差称为金属的电极电势。(1)标准氢电极θ(H+/H2)=0.0000V标准氢电极符号H+(1.0mol/L)|H2(101.325kPa)|Pt(+)电对符号H+/H22.电极电势的确定T=298.15KPθ=101.325kPac(H+)=1.0mol/L(2)其它电对θ的确定方法:将待测电极与标准氢电极组成原电池如Cu2+/CuEθ=0.3419VEθ=θ(Cu2+/Cu)-θ(H+/H2)=0.3419Vθ(Cu2+/Cu)=0.3419V如Zn2+/ZnEθ=0.7618VEθ=θ(H+/H2)-θ(Zn2+/Zn)=0.7618Vθ(Zn2+/Zn)=-0.7...