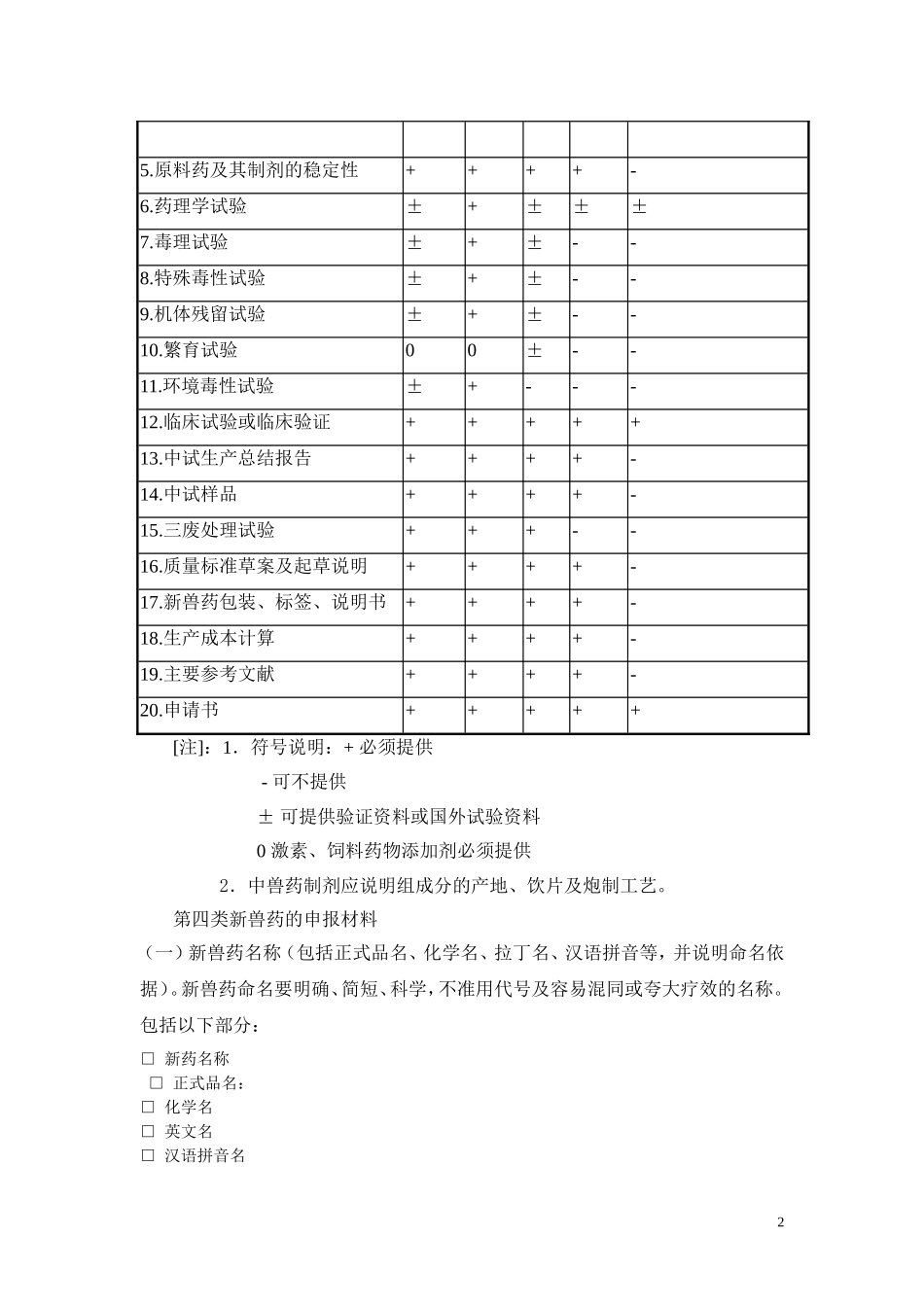
第四类新兽药的申报新兽药是指我国新研制的兽药原料药品及其制剂。兽药新制剂系指用国家已批准的兽药原料药品新研制、加工出的兽药制剂。已批准生产的兽药制剂,凡改变处方、剂型、给药途径和增加新的适应症的亦属兽药新制剂。新兽药分以下五类:第一类我国创制的原料药品及其制剂(包括天然药物中提取的及合成的新发现的有效单体及其制剂);我国研制的国外未批准生产、仅有文献报道的原料药品及其制剂。新发现的中药材;中药材新的药用部位。第二类我国研制的国外已批准生产,但未列入国家药典、兽药典或国家法定药品标准的原料药品及其制剂。天然药物中提取的有效部分及其制剂。第三类我国研制的国外已批准生产,并已列入国家药典、兽药典或国家法定药品标准的原料药品及其制剂;天然药物中已知有效单体用合成或半合成方法制取的原料药品及其制剂。西兽药复方制剂,中西兽药复方制剂。第四类改变剂型或改变给药途径的药品。新的中药制剂(包括古方、秘方、验方、改变传统处方组成的);改变剂型但不改变给药途径的中成药。第五类增加适应症的西兽药制剂、中兽药制剂(中成药)。新兽药申报资料项目表申报资料项目新兽药类别第一类第二类第三类第四类第五类1.新兽药名称及命名依据++++-2.选题目的、依据及国内外概况+++++3.确证结构与组分++±--4.生产工艺++++-15.原料药及其制剂的稳定性++++-6.药理学试验±+±±±7.毒理试验±+±--8.特殊毒性试验±+±--9.机体残留试验±+±--10.繁育试验00±--11.环境毒性试验±+---12.临床试验或临床验证+++++13.中试生产总结报告++++-14.中试样品++++-15.三废处理试验+++--16.质量标准草案及起草说明++++-17.新兽药包装、标签、说明书++++-18.生产成本计算++++-19.主要参考文献++++-20.申请书+++++[注]:1.符号说明:+必须提供-可不提供±可提供验证资料或国外试验资料0激素、饲料药物添加剂必须提供2.中兽药制剂应说明组成分的产地、饮片及炮制工艺。第四类新兽药的申报材料(一)新兽药名称(包括正式品名、化学名、拉丁名、汉语拼音等,并说明命名依据)。新兽药命名要明确、简短、科学,不准用代号及容易混同或夸大疗效的名称。包括以下部分:□新药名称□正式品名:□化学名□英文名□汉语拼音名2□商品名一、由汉字组成,不得使用图形、字母、数字、符号等标志。二、不得使用同中华人民共和国国家名称相同或者近似的,以及同中央国家机关所在地特定地点名称或者标志性建筑物名称相同的文字。三、不得使用同外国国家名称相同或者近似的文字,但该国政府同意的除外。四、不得使用同政府间国际组织名称相同或者近似的文字,但经该组织同意或者不易误导公众的除外。五、不得使用带有民族歧视性的文字。六、不得使用夸大宣传或带有欺骗性的文字。七、不得使用有害于社会主义道德风尚或者有其他不良影响的文字。八、不得使用国际非专利药名(INN)中文译名及其主要字词的文字。九、不得使用不科学地表示功效、扩大或者夸大产品疗效的文字。十、不得使用明示或暗示适应所有病症的文字。十一、不得使用直接表示产品剂型、原料的文字。十二、不得使用与兽药通用名称音似或者形似的文字。十三、不得使用兽药习用名称或者曾用名称。十四、不得使用人名、地名或者其他有特定含义的文字。十五、不同品种兽药不得使用同一商品名称。十六、同一兽药生产企业生产的同一种兽药,成分相同但剂型或规格不同的,应当使用同一商品名称。3(注明是研制单位提名还是国外的商品名,不得使用已注册的商品名。避免采用可能给以暗示的有关药理学、解剖学、生理学、病理学或治疗学的药品名称)。□命名依据□原料药正式品名的命名原则(参考卫生部药典会编订的“中国药品通用名称命名原则”)□制剂正式品名的命名原则(参考卫生部药典会编订的“中国药品通用名称命名原则”)(二)选题的目的与依据,国内外有关该药研究现状或生产、使用情况的综述。□国内外有关该品同类产品概况□国外有关该品的研究现状与生产及临床使用情况□国内有关该品的研究现状与生产及临床使用情况□国内外有关该品的专利及行政保护检索情况□国内外有关该品的近期文献(三)新兽药的...