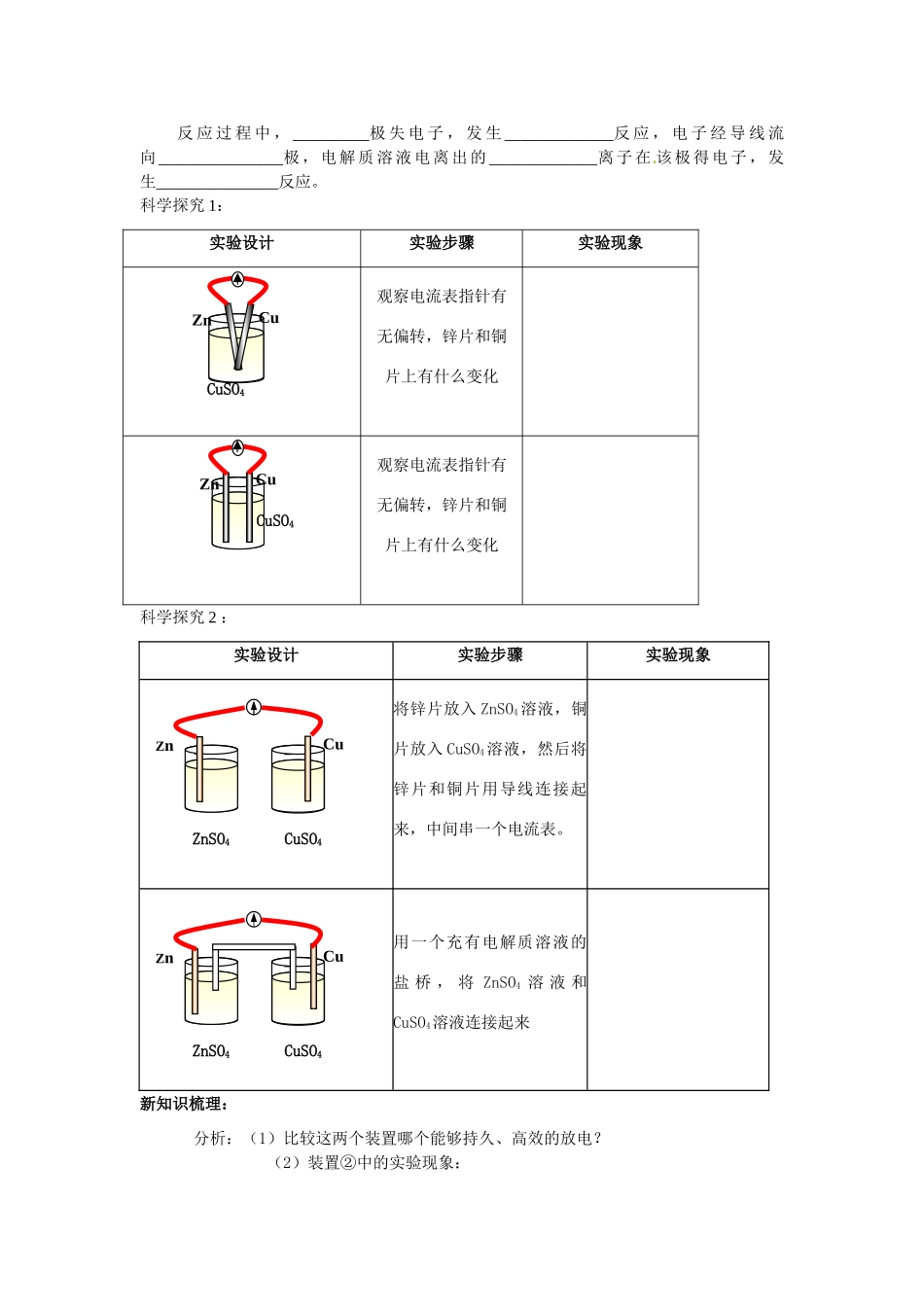
安徽省怀远县包集中学高中化学选修四教学案:第四章第一节原电池学案一、预习目标预习预习醛的结构以及物理和化学性质初步学会书写相关反应方程式。二、预习内容温故而知新1:如右图回答问题:1、定义:把转换为的装置。2、写出Zn片和Cu片上发生的电极反应和电池总反应负极:正极:总反应:3、图上注明外电路中的电子流向。内电路:阳离子向_______极移动,阴离子向_______极移动。4、原电池反应本质:反应。温故而知新2:判断下列装置能否形成原电池形成原电池的条件:1、___________________________________________2、___________________________________________3、___________________________________________课内探究学案一、学习目标1.掌握构成原电池的条件2.理解原电池的原理H2SO4CuZnZnCuuCuSO4ZnSO4CuSO4ZnCuZnC酒精ZnCuSO4Zn3.学会原电池的正负极及电极反应式的书写方法学习重难点:原电池的原理二、学习过程一、原电池1、原电池的构成条件实验探究:Zn与Cu插入稀硫酸的现象与解释(表1)实验顺序金属实验现象解释能量的转化关系①Zn、Cu单独插入稀H2SO4溶液Zn片Cu片②Zn、Cu导线连接并连接灵敏电流表后插入稀H2SO4Zn片Cu片电流表(1)原电池的概念:将能转化为能的装置。(2)写出上面原电池负极和正极的电极反应式和原电池总反应。负极(Zn):正极(Cu):总反应(离子方程式)探究:以下装置哪些能构成原电池,哪些不能构成原电池,并说明理由。(3)构成原电池的条件①。电极名称:极电子流向,发生反应,材料活泼性极电子流向,发生反应,材料活泼性②。外电路:电子从极流向极,电流从极流向极。内电路:阴离子移向极,阳离子移向极,电流从极流向极。③。电解质溶液作用:。④。2、原电池的工作原理反应过程中,极失电子,发生反应,电子经导线流向极,电解质溶液电离出的离子在该极得电子,发生反应。科学探究1:实验设计实验步骤实验现象观察电流表指针有无偏转,锌片和铜片上有什么变化观察电流表指针有无偏转,锌片和铜片上有什么变化科学探究2:实验设计实验步骤实验现象将锌片放入ZnSO4溶液,铜片放入CuSO4溶液,然后将锌片和铜片用导线连接起来,中间串一个电流表。用一个充有电解质溶液的盐桥,将ZnSO4溶液和CuSO4溶液连接起来新知识梳理:分析:(1)比较这两个装置哪个能够持久、高效的放电?(2)装置②中的实验现象:ZnSO4CuSO4ZnCuZnSO4CuSO4ZnCuCuZnCuSO4CuZnCuSO4a、有盐桥时电流计指针b、锌片逐渐c、铜片d、取出盐桥后,电流计指针(3)写出装置②中电极反应式和原电池的总反应。(4)分析盐桥的作用:①。②。当堂检测:1、把a、b、c、d四块金属浸泡在稀硫酸中,用导线两两相连可以组成各种原电池.若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极.则这四种金属的活动性顺序由大到小为A.A>b>c>dB.A>c>d>bC.C>a>b>dD.B>d>c>a2、如图4—14所示的装置能够组成原电池且产生电流的是3、用Cu+2AgNO3=Cu(NO3)2+2Ag设计原电池,画出装置图,并写出电极反应式。课后练习与提高一、选择题1.下列各组成金属和溶液,能组成原电池的是ACu、Cu、稀硫酸BZn、Cu、稀硫酸CCu、Zn、酒精DZn、Cu、CuSO4溶液2.有a、b、c、d四种金属。将a与b用导线联接起来,浸入电解质溶液中,b不易腐蚀。将a、b分别投入等浓度盐酸中,d比a反应剧烈。将铜浸入b的盐溶液里,无明显变化。如果把铜浸入c的盐溶液里,有金属c析出。据此判断它们的活动性由强到弱的顺序是()AdcabB.dabcC.dbacD.badc3.在稀硫酸中放入一块镀层严重损坏的白铁片,放出气体的速率是A时快时慢B先慢后快C先快后慢D保持不变4.将铁片和银片用导线连接置于同一稀盐酸溶液中,并经过一段时间后,下列各叙述正确的是()A.负极有Cl逸出,正极有H+逸出B.负极附近Cl的浓度减小C.正极附近Cl的浓度逐渐增大D.溶液中Cl的浓度基本不变5.把铁钉和碳棒用铜线联接后,浸入0.01mol/L的食盐溶液中,可能发生的现象是()A碳棒上放出氯气B.碳棒近旁产生OH-C.碳棒上放出氧气D.铁钉上放出氢气E.铁钉被氧化6.钢铁发生吸氧腐蚀时,...