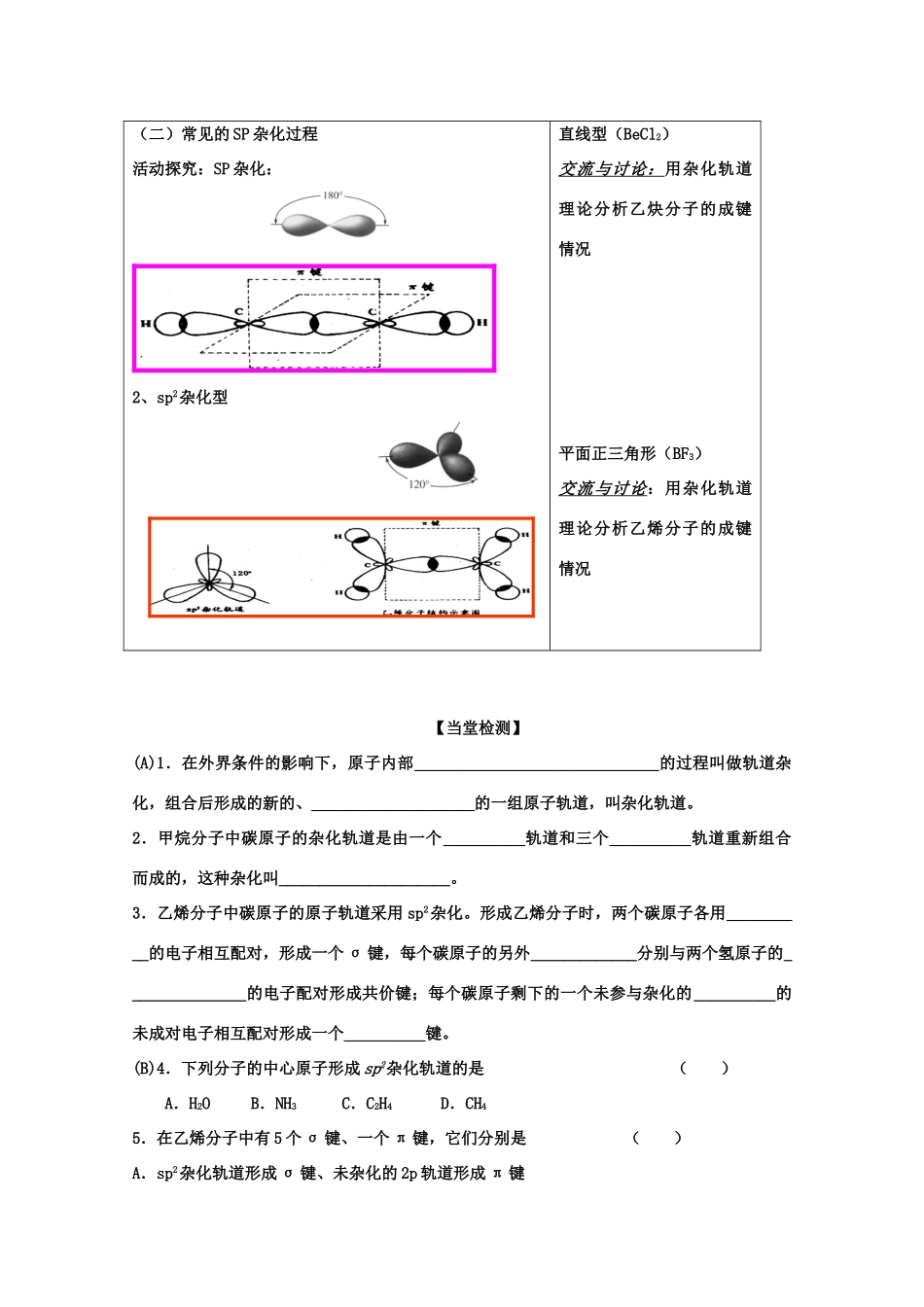
第二节共价键与分子的立体结构(第1课时)班级__________姓名__________【学习目标】1、理解杂化轨道理论的主要内容,掌握三种主要的杂化轨道类型;2、学会用杂化轨道原理解释常见分子的成键情况与空间构型【学习重难点】重点:杂化轨道类型难点:杂化轨道类型【学案导学过程】活动·探究原理规律方法技巧(一)甲烷分子的形成及立体构型联想质疑:1、共价键决定原子的结合方式,决定分子的空间构型吗?2、利用电子配对理论能解释甲烷的空间构型吗3、为了解释甲烷的空间构型鲍林提出了什么理论?4、甲烷分子形成过程:C:2s22px12py13pz观察左图你能用语言描述一下甲烷的空间构型的形成过程吗?思考:1原子轨道为什么可以进行杂化?(提示从共价键键能大小和体系能量变化来分析)2、轨道杂化后在数目,形状,能量上是否发生变化?3、轨道杂化的结果是什么?4、尝试解释轨道杂化(二)常见的SP杂化过程活动探究:SP杂化:2、sp2杂化型直线型(BeCl2)交流与讨论:用杂化轨道理论分析乙炔分子的成键情况平面正三角形(BF3)交流与讨论:用杂化轨道理论分析乙烯分子的成键情况【当堂检测】(A)1.在外界条件的影响下,原子内部______________________________的过程叫做轨道杂化,组合后形成的新的、____________________的一组原子轨道,叫杂化轨道。2.甲烷分子中碳原子的杂化轨道是由一个__________轨道和三个__________轨道重新组合而成的,这种杂化叫_____________________。3.乙烯分子中碳原子的原子轨道采用sp2杂化。形成乙烯分子时,两个碳原子各用__________的电子相互配对,形成一个σ键,每个碳原子的另外_____________分别与两个氢原子的_______________的电子配对形成共价键;每个碳原子剩下的一个未参与杂化的__________的未成对电子相互配对形成一个__________键。(B)4.下列分子的中心原子形成sp2杂化轨道的是()A.H2OB.NH3C.C2H4D.CH45.在乙烯分子中有5个σ键、一个π键,它们分别是()A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键C.C-H之间是sp2形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键学后反思我的收获我还有待提高的