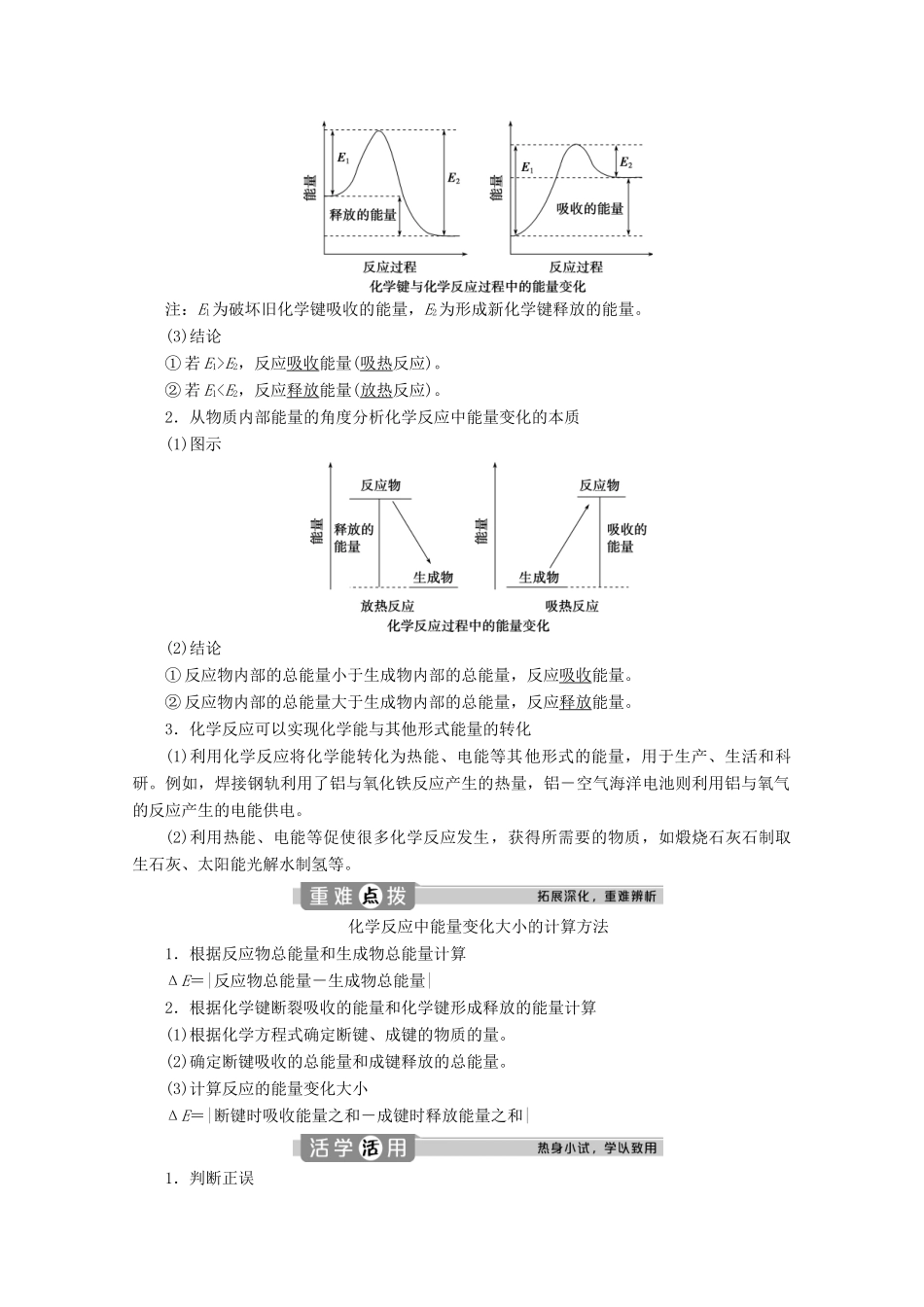
第1课时化学反应中能量变化的本质及转化形式课程标准核心素养1.认识物质具有能量,认识放热反应和吸热反应。2.知道化学反应可以实现与其他能量形式的转化。3.了解化学反应中能量变化的本质。1.变化观念与平衡思想认识化学反应中能量变化的本质。2.宏观辨识与微观探析能从宏观(反应物和生成物的总能量)和微观(化学键的断裂和形成)相结合的视角分析化学反应中能量的变化。化学反应中的能量变化1.化学反应中的能量变化实验内容实验现象化学方程式及结论NaOH溶液与盐酸反应混合液的温度升高化学方程式:NaOH+HCl===NaCl+H2O;结论:反应释放能量锌与盐酸反应有大量气泡产生,溶液温度升高化学方程式:Zn+2HCl===ZnCl2+H2↑;结论:反应释放能量碳酸氢钠与柠檬酸反应混合液的温度降低结论:反应吸收能量结论:每一个化学反应都伴随着能量的变化,有的反应释放能量,有的反应吸收能量。2.化学反应的分类(从能量变化角度)(1)放热反应:最终表现为释放热量的化学反应。(2)吸热反应:最终表现为吸收热量的化学反应。1.常见的放热反应(1)所有的燃烧反应,如木炭、H2、CH4等在氧气中的燃烧,H2在Cl2中的燃烧。(2)酸碱中和反应,如H++OH-===H2O。(3)大多数的化合反应,如H2+Cl2=====2HCl。(4)铝热反应,如2Al+Fe2O3=====Al2O3+2Fe。(5)活泼金属与酸或H2O的反应,如2Al+6H+===2Al3++3H2↑,2Na+2H2O===2Na++2OH-+H2↑。2.常见的吸热反应(1)消石灰[Ca(OH)2]与氯化铵固体的反应:Ca(OH)2+2NH4Cl=====CaCl2+2NH3↑+2H2O。(2)大多数的分解反应,如NH4Cl=====HCl↑+NH3↑。(3)碳与水蒸气的反应:C+H2O(g)=====CO+H2。(4)部分以C、H2、CO为还原剂的氧化还原反应,如C+CO2=====2CO。吸热反应和放热反应均是化学反应。NaOH固体溶于水、浓H2SO4的稀释,属于放热过程,不属于放热反应;NH4NO3固体溶于水属于吸热过程,不属于吸热反应。1.判断正误(1)化学变化遵循质量守恒和能量守恒。()(2)有能量变化的过程一定发生了化学反应。()(3)化学反应中化学能只能转变为热能。()(4)需要点燃或加热才能发生的反应一定是吸热反应。()(5)电解水的过程是电能转化为热能。()答案:(1)√(2)×(3)×(4)×(5)×2.下列反应属于吸热反应的是()A.铝与CuCl2溶液反应B.NaOH和HCl反应C.NaOH与NH4Cl反应D.甲烷燃烧解析:选C。需要识记常见的放热反应和吸热反应。3.下列反应中属于放热反应的是________,属于吸热反应的是________。①煅烧石灰石制生石灰(CaO)②燃烧木炭取暖③炸药爆炸④NaOH溶液与盐酸的反应⑤生石灰与水作用制熟石灰⑥食物因氧化而腐败⑦硝酸铵溶于水答案:②③④⑤⑥①化学反应中能量变化的本质及转化形式1.从化学键的角度分析化学反应中能量变化的本质(1)实例分析断键时吸收的总能量:436kJ+249kJ=685kJ;成键时释放的总能量:930kJ;所以1molH2燃烧生成水蒸气时释放能量245kJ。(2)图示注:E1为破坏旧化学键吸收的能量,E2为形成新化学键释放的能量。(3)结论①若E1>E2,反应吸收能量(吸热反应)。②若E1