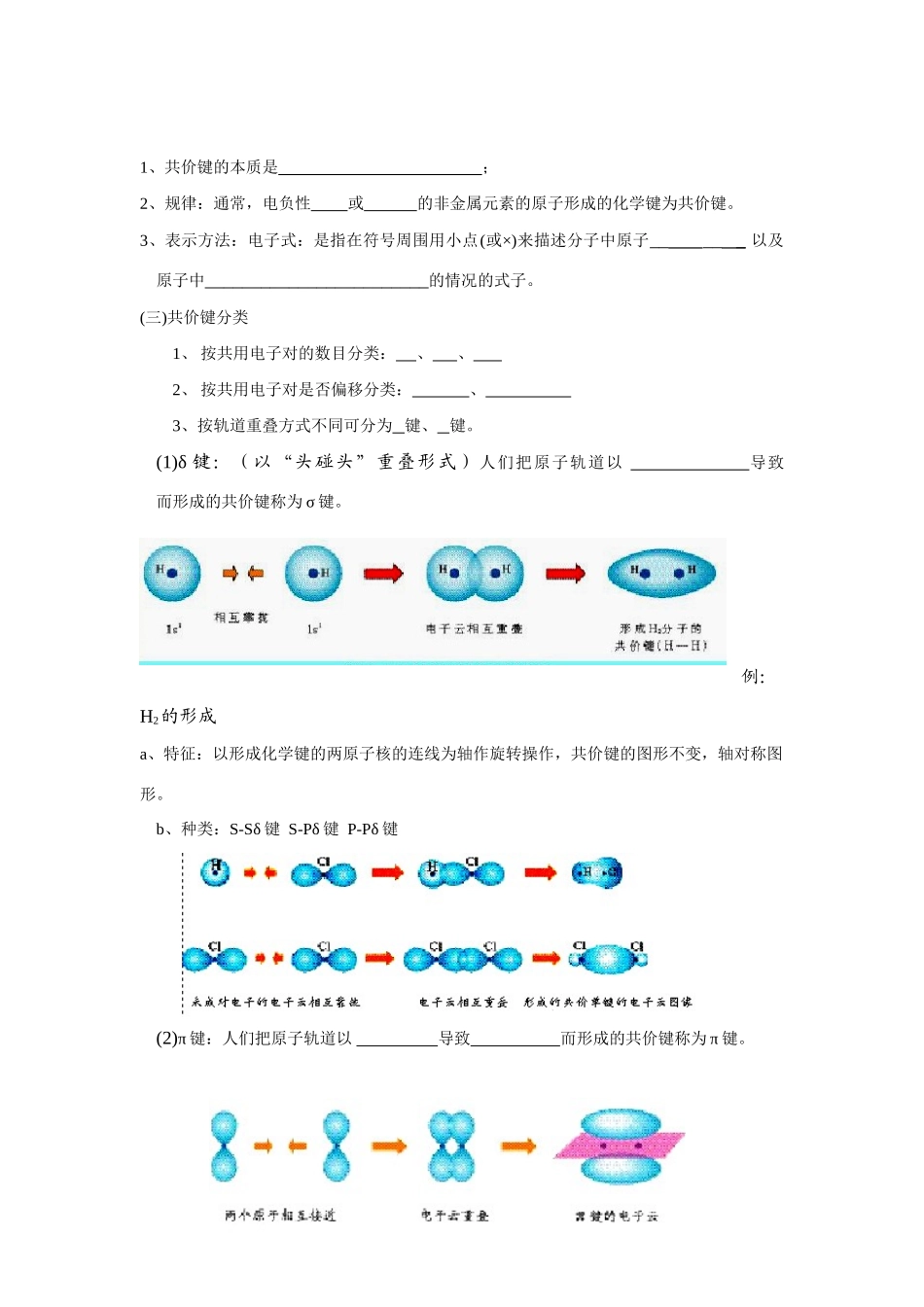
第2章微粒之间的相互作用第1节共价键模型【学习目标】1、知识与技能目标使学生理解共价键的概念,初步掌握共价键的形成,加深对电子配对法的理解;能较为熟练地用电子式表示共价分子的形成过程和分子结构;正确判断非极性键和极性键;初步了解键能、键长、键角的概念,能根据其数据认识共价键的强弱。2、过程与方法目标(1)通过学生对离子键和共价键的认识与理解,培养学生的抽象思维能力;通过电子式的书写,培养学生的归纳比较能力。(2)在学习过程中,激发学生的学习兴趣和求知欲。(3)培养学生从宏观到微观,从现象到本质的认识事物的科学方法。3、情感态度·价值观目标(1)通过对共价键形成过程的分析,培养学生怀疑、求实、创新的精神。(2)通过观察模拟微观结构的三维动画,增强空间想象能力。学习重点:掌握共价键的形成,并能较为熟练地用电子式表示简单共价分子的形成过程。学习难点:1、较复杂的物质电子式和结构式分析。2、从微观的角度和三维空间上想象物质的结构。第1课时【预习提纲】一、共价键:(一)定义:原子通过而形成的化学键称为共价键;(二)共价键的形成及本质:NaCl、HCl的形成过程1、共价键的本质是;2、规律:通常,电负性或的非金属元素的原子形成的化学键为共价键。3、表示方法:电子式:是指在符号周围用小点(或×)来描述分子中原子_____以及原子中________________________的情况的式子。(三)共价键分类1、按共用电子对的数目分类:、、2、按共用电子对是否偏移分类:、3、按轨道重叠方式不同可分为键、键。(1)δ键:(以“头碰头”重叠形式)人们把原子轨道以导致而形成的共价键称为σ键。例:H2的形成a、特征:以形成化学键的两原子核的连线为轴作旋转操作,共价键的图形不变,轴对称图形。b、种类:S-Sδ键S-Pδ键P-Pδ键(2)π键:人们把原子轨道以导致而形成的共价键称为π键。a.特征:每个π键的电子云有两块组成,分别位于有两原子核构成平面的两侧,如果以它们之间包含原子核的平面镜面,它们互为镜像,这种特征称为镜像对称。(3)δ键和π键比较①重叠方式δ键:头碰头π键:肩并肩②δ键比π键的强度较大③成键电子:δ键S-SS-PP-Pπ键P-P④δ键成单键π键成双键、叁键(双键中含有一个δ键和一个π键,叁键中含有一个δ键和两个π键)⑤在由两个原子形成的多个共价键中,只能有一个键,而键可以是一个或多个。【例题】下列分子中存在π键的是A.H2B.Cl2C.N2D.HCl【达标训练】1.下列关于化学键的说法不正确的是A.化学键是一种作用力B.化学键可以是原子间作用力,也可以是离子间作用力C.化学键存在于分子内部D.化学键存在于分子之间2.对δ键的认识不正确的是A.δ键不属于共价键,是另一种化学键B.S-Sδ键与S-Pδ键的对称性相同C.分子中含有共价键,则至少含有一个δ键D.含有π键的化合物与只含δ键的化合物的化学性质不同3.下列物质中,属于共价化合物的是A.I2B.BaCl2C.H2SO4D.NaOH4.下列化合物中,属于离子化合物的是A.KNO3B.BeClC.KO2D.H2O25.写出下列物质的电子式。H2、N2、HCl、H2O6.用电子式表示下列化合物的形成过程HCl、NaBr、MgF2、Na2S、CO2第二课时【预习提纲】一、共价键:(四).共价键的特征1、饱和性:因为每个原子所提供的的数目是一定的,所以在共价键的形成过程中,一个原子的未成对电子与另一个原子中未成对电子配对成键后,,一般不能与其它原子的未成对电子配对成键了,就即每个原子所能,这称为共价键的饱和性。显然,共价键的饱和性决定了各种原子形成分子时相结合的关系。2、方向性:在形成共价键时,愈多,电子愈大,所形成的共价键愈,因此共价键尽可能沿着,这就是共价键的方向性。共价键的方向性决定了分子的立体空间构型。二、键参数1、键能①概念:②单位:③键能越大,形成化学键放出的能量越大,化学键越稳定,越不易断裂。2、键长①概念:②单位:1pm(1pm=10-12m)③键长越短,共价键越牢固,形成的物质越稳定几种共价键的键长H-H0.74×10-10mC-C1.54×10-10mCl-Cl1.98×10-10mN-N1.15×10-10m3、键角:多原子分子中的两个共价键之间的夹角。例如:CO2结构为O...