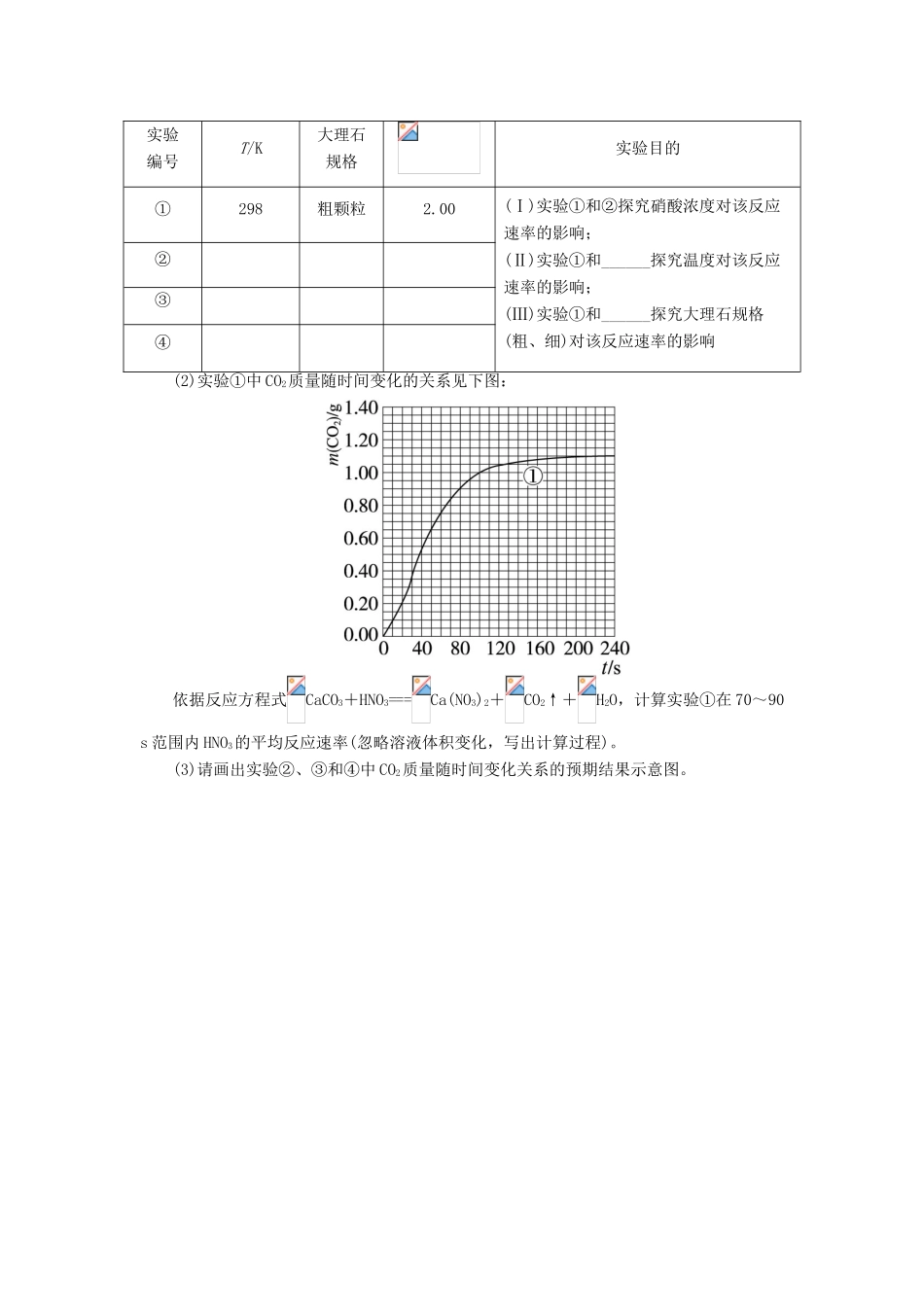
专题四化学反应条件的控制课题1硫代硫酸钠与酸反应速率的影响因素1.将ag块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示。在相同的条件下,将bg(a>b)粉末状碳酸钙与同浓度的盐酸反应,则相应的曲线(图中虚线所示)正确的是()2.检查钢质设备完好性的方法之一是在被怀疑有裂纹处涂上10%的盐酸,过一段时间,如观察到有粗线裂纹,表明该部分原先确有裂纹,产生粗线裂纹的原因是()A.裂纹处尘埃多,起催化作用B.裂纹里面含水分C.裂纹处铁的表面积大,反应快D.原裂纹处的Fe2O3与盐酸反应,生成可溶的FeCl33.把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是()A.盐酸的浓度B.铝条的表面积C.溶液的温度D.加少量Na2SO4固体4.下列不同条件下的化学反应A+B===C+D,反应速率由大到小的顺序正确的一组是()①常温下20mL含A和B各0.001mol的溶液;②常温下100mL含A和B各0.01mol的溶液;③常温下0.05mol·L-1A和B溶液各10mL,加到20mL蒸馏水中;④常温下80mL含A0.01mol的溶液和20mL含B0.005mol的溶液。(注:不考虑液体混合时的体积变化)A.①②③④B.④③②①C.②④①③D.②①④③5.为加速漂白粉的漂白作用,最好的办法是()A.用水湿润B.加热干燥C.加NaOHD.滴入少量稀盐酸6.某学生做浓度对反应速率的影响的实验时,将3只试管编号为①②③,并按下表中物质的量进行实验,记录下的实验数据是:16s、28s、33s。请将3个数据填入下表的适当位置,并写出实验结论。试管编号加3%Na2S2O3溶液(mL)加H2O2溶液(mL)加H2SO4(1∶5)出现浑浊时间①335滴(a)s②425滴(b)s③515滴(c)s(1)将对应①②③的时间分别写出:(a)__________,(b)__________,(c)__________。(2)实验结论:_______________________________________________________。(3)写出反应的化学方程式:__________________________________________________。7.以下列反应为例,验证浓度对化学反应速率的影响:Na2S2O3+2HCl===2NaCl+S↓+SO2↑+H2O。一同学在下午活动课中,配制了0.2mol·L-1的盐酸置于大烧杯中,并取了3mL0.1mol·L-1Na2S2O3溶液与3mL该盐酸反应,产生明显浑浊约需时间ts。由于时间另有安排,停止了实验。第二天又用了3mL0.2mol·L-1Na2S2O3溶液与原盐酸3mL反应,产生明显浑浊也需时间ts左右。于是他得出了结论:浓度对化学反应速率的影响不大。请你评价该同学的这次实验。(1)结论是________。A.可靠的B.不可靠的C.基本正确,但有疑点D.可能正确,也可能不正确(2)一般对比实验要控制条件,且再现性好。①请你评价他实验控制的条件:________________________________________________。②请你评价他实验现象的对比方法:________;若他的对比方法不好,请你给出合理的对比方法(若他的对比方法可行;此问可不答)。(3)选择实验所需的试剂,采用两种不同的方法区分0.1mol·L-1H2SO4和0.01mol·L-1的H2SO4,并简述操作过程。试剂:①紫色石蕊试剂;②蒸馏水;③BaCl2溶液;④pH试纸;⑤0.1mol·L-1Na2S2O3溶液。8.某探究小组用硝酸与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用硝酸浓度为1.00mol·L-1、2.00mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验硝酸的用量为25.0mL、大理石用量为10.00g。(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:实验编号T/K大理石规格实验目的①298粗颗粒2.00(Ⅰ)实验①和②探究硝酸浓度对该反应速率的影响;(Ⅱ)实验①和______探究温度对该反应速率的影响;(Ⅲ)实验①和______探究大理石规格(粗、细)对该反应速率的影响②③④(2)实验①中CO2质量随时间变化的关系见下图:依据反应方程式CaCO3+HNO3===Ca(NO3)2+CO2↑+H2O,计算实验①在70~90s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。(3)请画出实验②、③和④中CO2质量随时间变化关系的预期结果示意图。参考答案1.答案:C解析:粉末状碳酸钙的表面积比块状碳酸钙的表面积大,故在相同条件下,与同浓度的盐酸反应时粉末的化学反应速率快,即单位时间内损失的CaCO3粉末的质量...