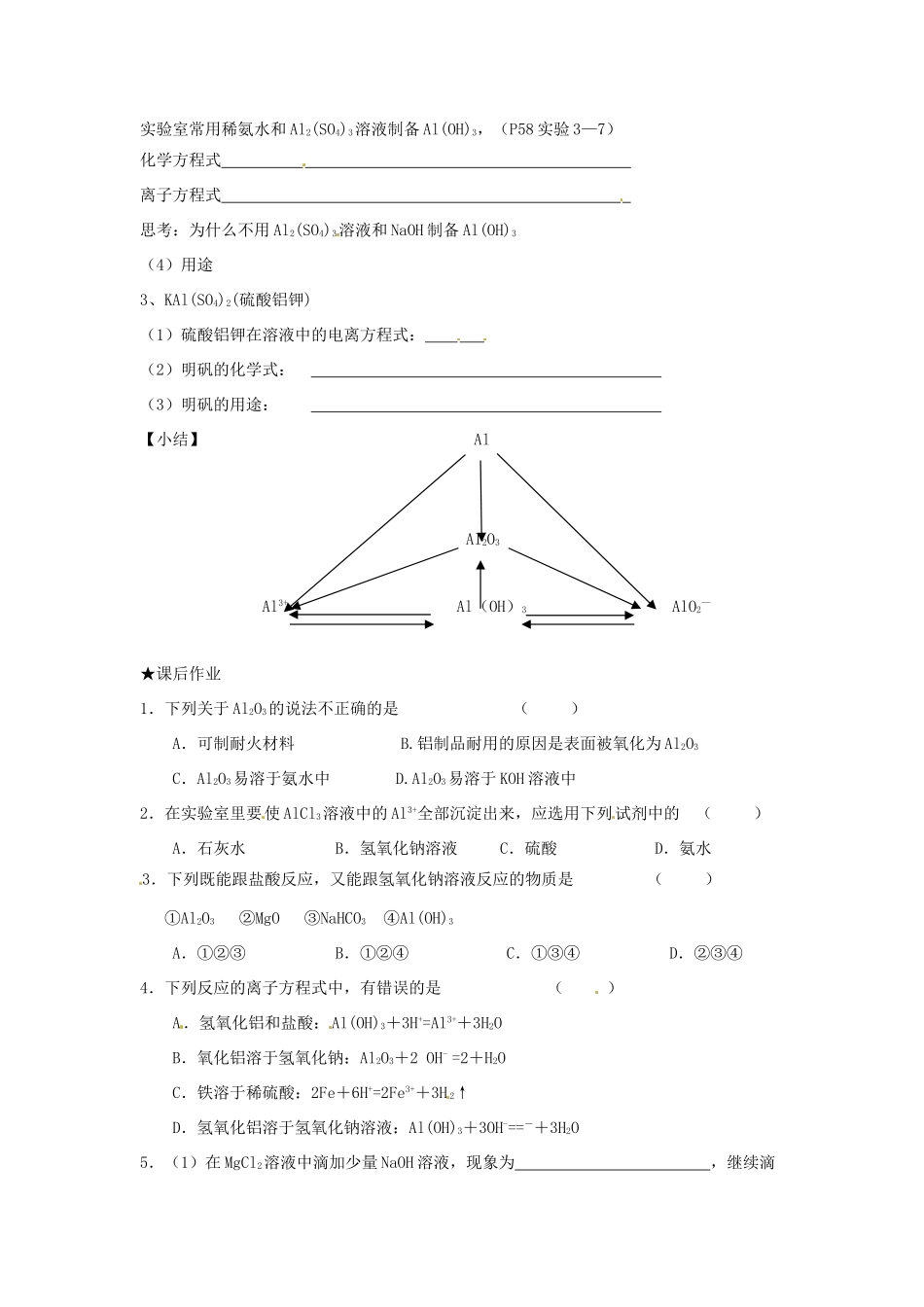
第三章第二节第2课时Al的化合物★学习目标1.掌握Al2O3、Al(OH)3的两性及其相关化学反应。★课前预备金属Al的化学性质:写出下列反应的离子方程式:Al与HCl:Al与NaOH:★知识体系阅读教材58-59页内容,回答下列问题1.Al2O3(氧化铝)(1)物理性质:。(2)化学性质:写出下列反应的化学方程式,并改成离子方程式。Al2O3和HCl,Al2O3和NaOH,结论:Al2O3既可以与酸反应又可以与强碱反应且都生成盐和水,因此Al2O3是氧化物。思考:为了除去MgO中的少量杂质Al2O3,可以选用什么试剂?(3)用途:。2.Al(OH)3(氢氧化铝)(1)物理性质(2)化学性质:写出下列反应的化学方程式,并改成离子方程式。(P58实验3—8)Al(OH)3和HCl,Al(OH)3和NaOH,结论:Al(OH)3既可以与酸反应,又可以与强碱反应,且都生成盐和水。因此Al(OH)3是氢氧化物。Al(OH)3受热分解(3)制备实验室常用稀氨水和Al2(SO4)3溶液制备Al(OH)3,(P58实验3—7)化学方程式离子方程式思考:为什么不用Al2(SO4)3溶液和NaOH制备Al(OH)3(4)用途3、KAl(SO4)2(硫酸铝钾)(1)硫酸铝钾在溶液中的电离方程式:(2)明矾的化学式:(3)明矾的用途:【小结】AlAl2O3Al3+Al(OH)3AlO2—★课后作业1.下列关于Al2O3的说法不正确的是()A.可制耐火材料B.铝制品耐用的原因是表面被氧化为Al2O3C.Al2O3易溶于氨水中D.Al2O3易溶于KOH溶液中2.在实验室里要使AlCl3溶液中的Al3+全部沉淀出来,应选用下列试剂中的()A.石灰水B.氢氧化钠溶液C.硫酸D.氨水3.下列既能跟盐酸反应,又能跟氢氧化钠溶液反应的物质是()①Al2O3②MgO③NaHCO3④Al(OH)3A.①②③B.①②④C.①③④D.②③④4.下列反应的离子方程式中,有错误的是()A.氢氧化铝和盐酸:Al(OH)3+3H+=Al3++3H2OB.氧化铝溶于氢氧化钠:Al2O3+2OH-=2+H2OC.铁溶于稀硫酸:2Fe+6H+=2Fe3++3H2↑D.氢氧化铝溶于氢氧化钠溶液:Al(OH)3+3OH-==-+3H2O5.(1)在MgCl2溶液中滴加少量NaOH溶液,现象为,继续滴加NaOH溶液,现象为。化学方程式为。离子方程式为。(2)在AlCl3溶液中滴加少量NaOH溶液,现象为,化学方程式为。离子化学方程式为。继续滴加NaOH溶液,现象为。化学方程式为。离子方程式为。【参考答案】第2课时铝的重要化合物★课前预备Al与HCl:2Al+6H+=2Al3++3H2↑Al与NaOH:2Al+2OH-+2H2O=2AlO2-+3H2↑★知识体系1.Al2O3(氧化铝)(1)物理性质:难溶于水,熔点高,耐高温(2)化学性质:Al2O3和HCl:Al2O3+6HCl=2AlCl3+3H2O,Al2O3+6H+=2Al3++3H2OAl2O3和NaOH:Al2O3+2NaOH=2NaAlO2+H2O,Al2O3+2OH-=2AlO2-+H2O结论:Al2O3既可以与酸反应又可以与强碱反应且都生成盐和水,因此Al2O3是两性氧化物。思考:为了除去MgO中的少量杂质Al2O3,可以选用什么试剂?答:NaOH或KOH(3)用途:耐火材料2.Al(OH)3(氢氧化铝)(1)物理性质:白色胶状沉淀。(2)化学性质:Al(OH)3和HCl:2Al(OH)3+6HCl=2AlCl3+3H2O,2Al(OH)3+6H+=2Al3++3H2OAl(OH)3和NaOH:Al(OH)3+NaOH=NaAlO2+2H2O,Al(OH)3+OH-=AlO2-+2H2O结论:Al(OH)3既可以与酸反应,又可以与强碱反应,且都生成盐和水。因此Al(OH)3是两性氢氧化物。Al(OH)3受热分解:2Al(OH)3Al2O3+3H2O(3)制备化学方程式:Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4离子方程式:2Al3++6NH3·H2O=2Al(OH)3↓+6NH4+思考:为什么不用Al2(SO4)3溶液和NaOH制备Al(OH)3?答:Al(OH)3会和过量NaOH反应,得不到Al(OH)3(4)用途:用于净水,中和胃酸。3、KAl(SO4)2(硫酸铝钾)(1)硫酸铝钾在溶液中的电离方程式:KAl(SO4)2=K++Al3++2SO42-(2)明矾的化学式:KAl(SO4)2(3)明矾的用途:用作净水剂【小结】AlAl2O3Al3+Al(OH)3AlO2—★课后作业1-4.CDCC5.(1)有白色沉淀生成白色沉淀不溶解2OH-+Mg2+﹦Mg(OH)2↓(2)有白色胶状沉淀生成AlCl3+3NaOH═Al(OH)3↓+3NaClAl3++3OH-═Al(OH)3↓沉淀逐渐溶解Al(OH)3+NaOH═NaAlO2+2H2OAl(OH)3+OH-═AlO2-+2H2O△