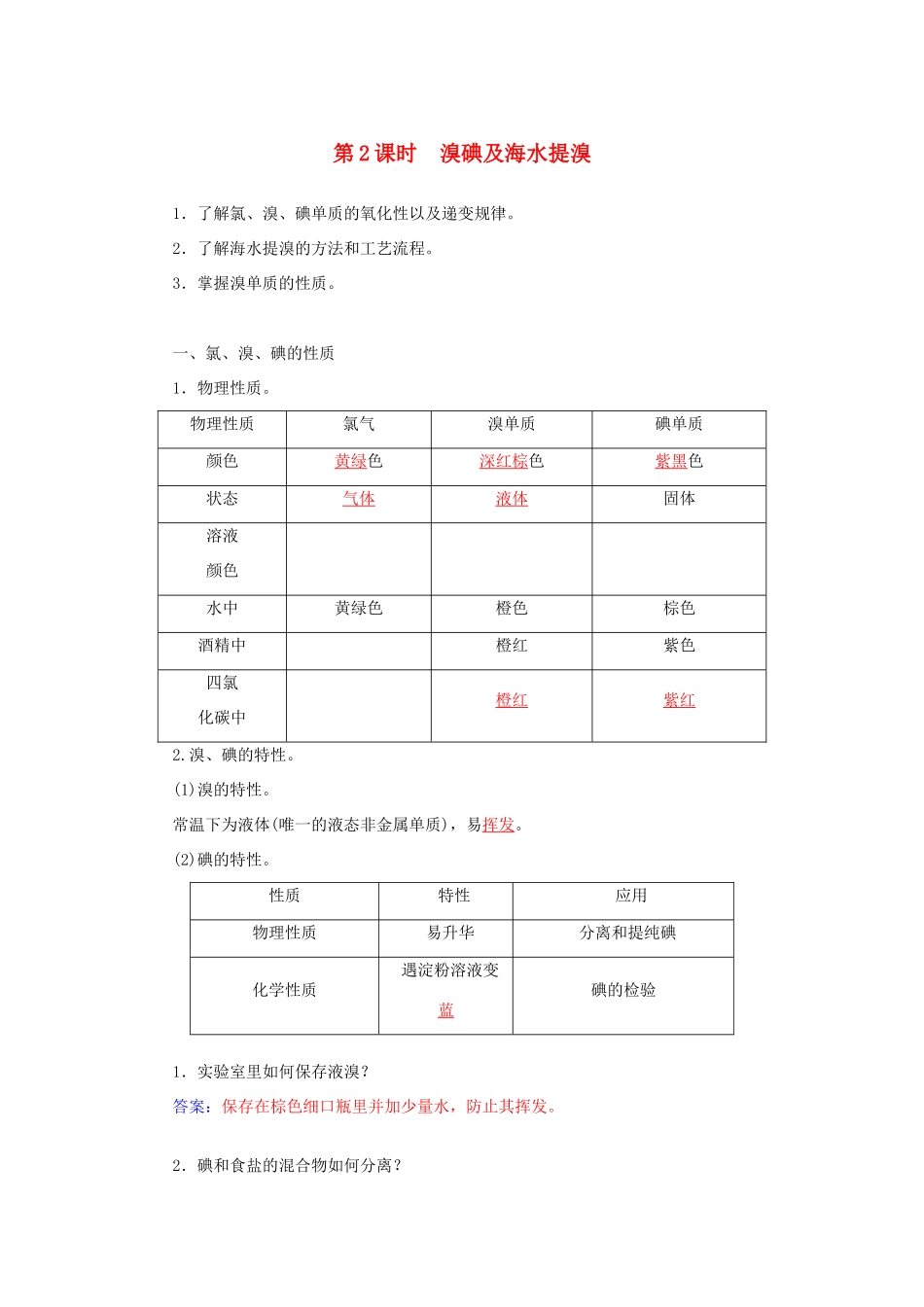
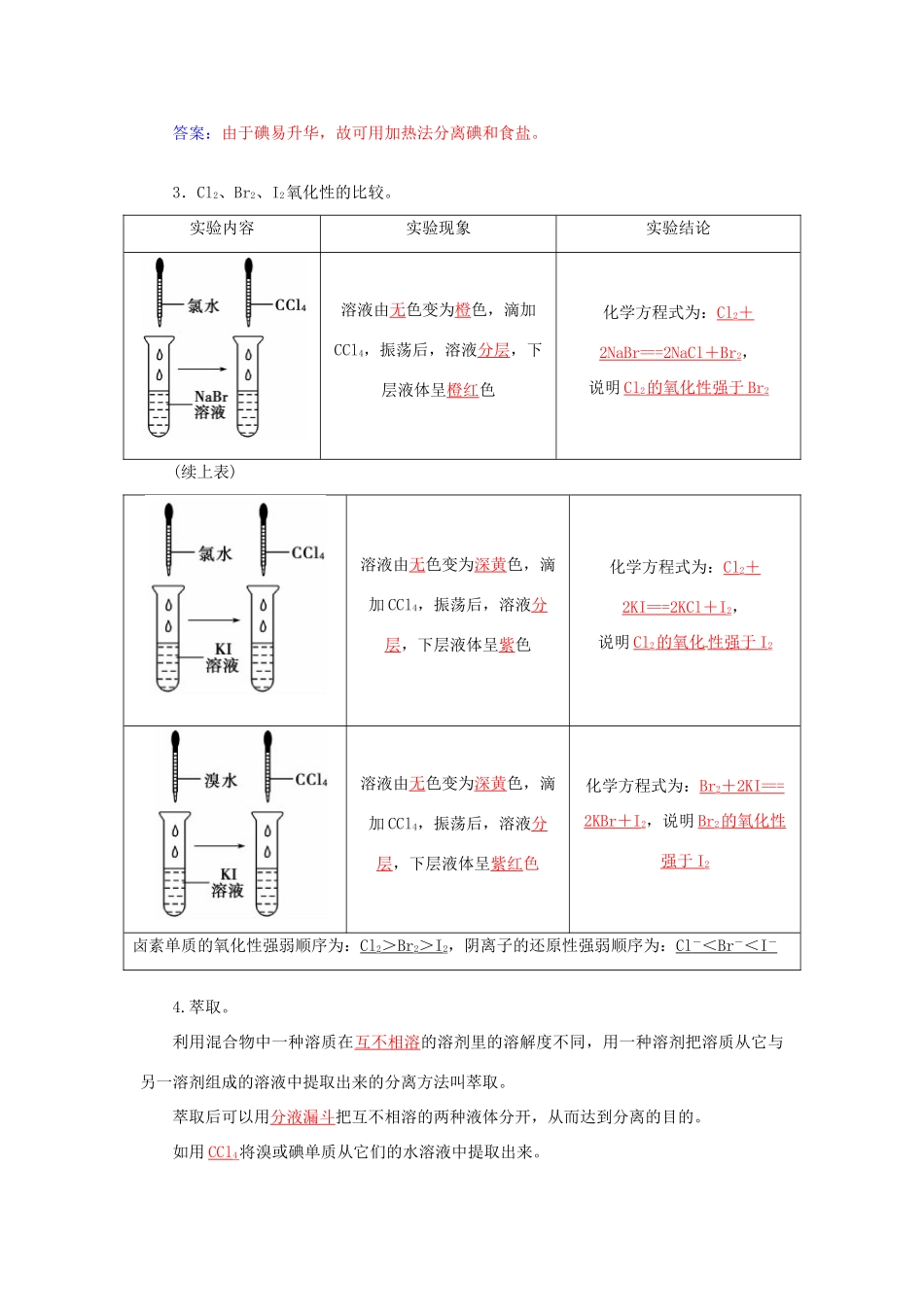
第2课时溴碘及海水提溴1.了解氯、溴、碘单质的氧化性以及递变规律。2.了解海水提溴的方法和工艺流程。3.掌握溴单质的性质。一、氯、溴、碘的性质1.物理性质。物理性质氯气溴单质碘单质颜色黄绿色深红棕色紫黑色状态气体液体固体溶液颜色水中黄绿色橙色棕色酒精中橙红紫色四氯化碳中橙红紫红2.溴、碘的特性。(1)溴的特性。常温下为液体(唯一的液态非金属单质),易挥发。(2)碘的特性。性质特性应用物理性质易升华分离和提纯碘化学性质遇淀粉溶液变蓝碘的检验1.实验室里如何保存液溴?答案:保存在棕色细口瓶里并加少量水,防止其挥发。2.碘和食盐的混合物如何分离?答案:由于碘易升华,故可用加热法分离碘和食盐。3.Cl2、Br2、I2氧化性的比较。实验内容实验现象实验结论溶液由无色变为橙色,滴加CCl4,振荡后,溶液分层,下层液体呈橙红色化学方程式为:Cl2+2NaBr===2NaCl+Br2,说明Cl2的氧化性强于Br2(续上表)溶液由无色变为深黄色,滴加CCl4,振荡后,溶液分层,下层液体呈紫色化学方程式为:Cl2+2KI===2KCl+I2,说明Cl2的氧化性强于I2溶液由无色变为深黄色,滴加CCl4,振荡后,溶液分层,下层液体呈紫红色化学方程式为:Br2+2KI===2KBr+I2,说明Br2的氧化性强于I2卤素单质的氧化性强弱顺序为:Cl2>Br2>I2,阴离子的还原性强弱顺序为:Cl-<Br-<I-4.萃取。利用混合物中一种溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一溶剂组成的溶液中提取出来的分离方法叫萃取。萃取后可以用分液漏斗把互不相溶的两种液体分开,从而达到分离的目的。如用CCl4将溴或碘单质从它们的水溶液中提取出来。3.能否用乙醇萃取溴水中的溴?为什么?答案:不能,因为乙醇和水互溶,不易分离。二、海水提溴1.溴的存在。99%的溴元素以Br-的形式存在于海水中,所以溴元素被人们称为“海洋元素”。2.从海水中提取溴。(1)主要原料:苦卤(海水晒盐后的母液)(2)步骤:浓缩―→氧化―→提取(3)原理:工业上,一般用Cl2作为提取溴的氧化剂,离子方程式为Cl2+2Br-===2Cl-+Br2。利用溴的挥发性,鼓入热空气或水蒸气,就可将溴分离出来。3.溴及其化合物的主要应用。(1)在工业上,溴大量地用来制造燃料的抗爆剂,见光容易分解的AgBr常被用做感光材料。(2)在农业生产中,常常使用含溴的杀虫剂。(3)在医药方面,溴化钠和溴化钾常被用做镇静剂。1.下列说法不正确的是(D)A.溴在海水中以化合态形式存在B.从海水中提取溴要经历浓缩、氧化和提取三个步骤C.提取时利用了溴单质的挥发性D.溴在常温下是液态,其颜色与氯气颜色相同解析:海水中的溴以化合态形式存在,溴在常温下为红棕色液体,而Cl2为黄绿色气体。2.下列实验方法中正确的是(B)A.用酒精从碘水中萃取碘B.用加热的方法从碘和沙子的化合物中分离出碘C.用淀粉溶液直接检出I-D.根据加入AgNO3溶液产生白色沉淀的现象认为溶液中含Cl-解析:利用萃取将物质分离,所选萃取剂的要求是萃取剂与溶剂互不相溶,而酒精和水可以任意比混溶,所以常用做萃取碘水中碘的萃取剂为苯或四氯化碳,故A错;碘易升华,利用这一性质可以将其与沙子分离,故B正确;淀粉遇I2变蓝,故不会直接检出I-,C错;SO、CO也能与Ag+反应产生白色沉淀,D错。3.现有三种溶液:①NaCl溶液②NaBr溶液③NaI溶液。(1)向①、②、③中分别滴入硝酸酸化的AgNO3溶液。其现象分别是:____________、____________、____________。(2)向①、②、③中分别通入Cl2,其现象分别是:________________、________________、________________。(3)向①、②、③中分别滴入溴水,其现象分别是:________________、________________、________________。解析:Ag+与Cl-、Br-、I-生成难溶于硝酸的AgCl(白)、AgBr(浅黄)、AgI(黄色)固体,此方法可用于Cl-、Br-、I-的检验。因氧化性Cl2>Br2>I2,还原性Cl-