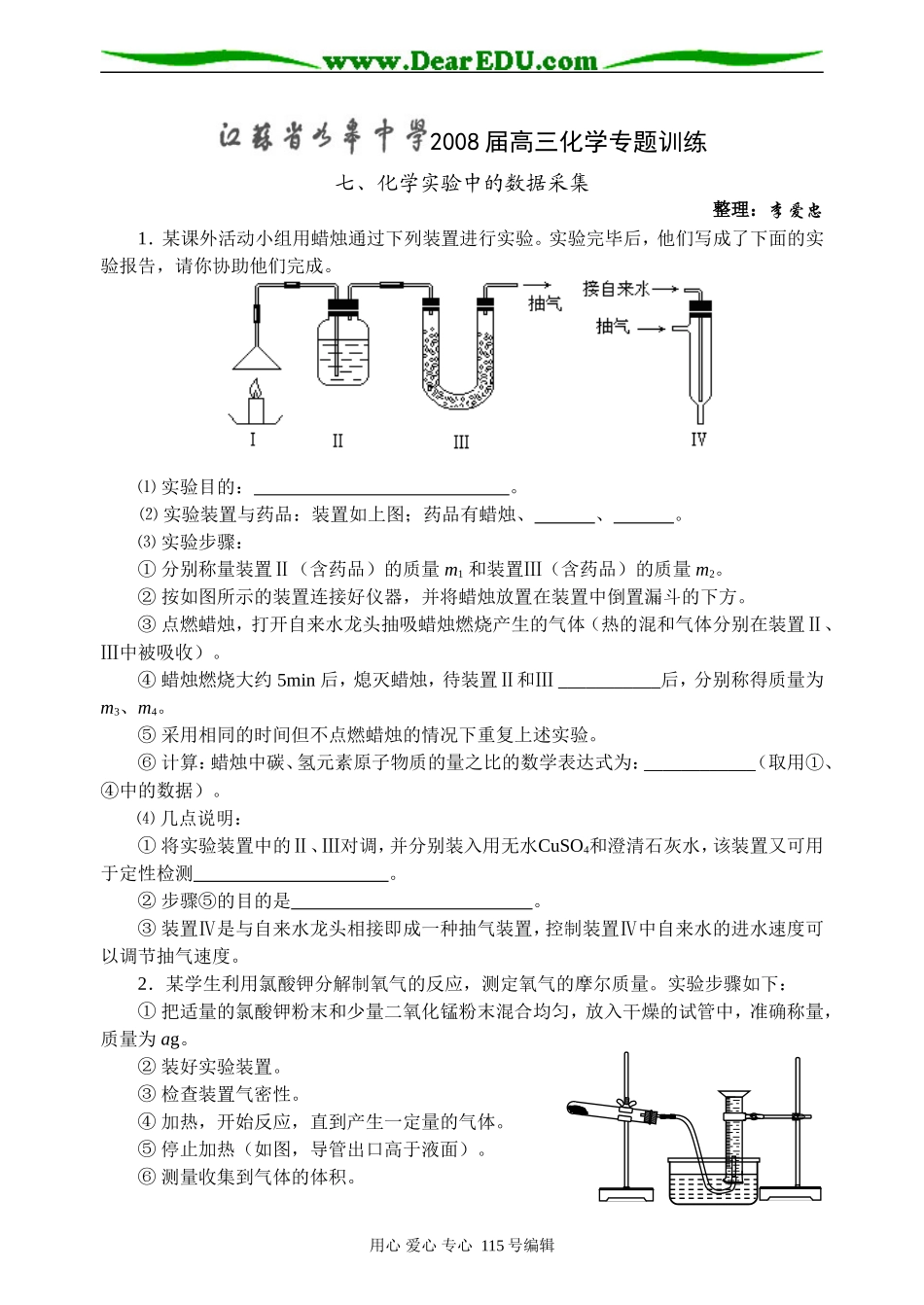
2008届高三化学专题训练七、化学实验中的数据采集整理:李爱忠1.某课外活动小组用蜡烛通过下列装置进行实验。实验完毕后,他们写成了下面的实验报告,请你协助他们完成。⑴实验目的:。⑵实验装置与药品:装置如上图;药品有蜡烛、、。⑶实验步骤:①分别称量装置Ⅱ(含药品)的质量m1和装置Ⅲ(含药品)的质量m2。②按如图所示的装置连接好仪器,并将蜡烛放置在装置中倒置漏斗的下方。③点燃蜡烛,打开自来水龙头抽吸蜡烛燃烧产生的气体(热的混和气体分别在装置Ⅱ、Ⅲ中被吸收)。④蜡烛燃烧大约5min后,熄灭蜡烛,待装置Ⅱ和Ⅲ___________后,分别称得质量为m3、m4。⑤采用相同的时间但不点燃蜡烛的情况下重复上述实验。⑥计算:蜡烛中碳、氢元素原子物质的量之比的数学表达式为:____________(取用①、④中的数据)。⑷几点说明:①将实验装置中的Ⅱ、Ⅲ对调,并分别装入用无水CuSO4和澄清石灰水,该装置又可用于定性检测。②步骤⑤的目的是。③装置Ⅳ是与自来水龙头相接即成一种抽气装置,控制装置Ⅳ中自来水的进水速度可以调节抽气速度。2.某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量。实验步骤如下:①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为ag。②装好实验装置。③检查装置气密性。④加热,开始反应,直到产生一定量的气体。⑤停止加热(如图,导管出口高于液面)。⑥测量收集到气体的体积。用心爱心专心115号编辑⑦准确称量试管和残留物的质量为bg。⑧测量实验室的温度。⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。⑩处理实验数据,求出氧气的摩尔质量。回答下列问题:⑴如何检查装置的气密性?。⑵以下是测量收集到气体体积必须包括的几个步骤:①调整量筒内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是:(请填写步骤代号)。⑶测量收集到气体体积时,如何使量简内外液面的高度相同?。⑷若实验中测得氧气体积是cL(已换算成标准状态),水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简):M(O2)=。3.现有某黄铜(铜、锌合金)的颗粒状样品约100mg,李洋同学将样品分为两等份,首先用右图所示装置测定黄铜样品中锌的质量分数和锌的相对原子质量。回答下列问题:⑴加入稀硫酸和黄铜中的锌完全反应,应如何操作?______________________________;反应前、后碱式滴定管中的液面高度与干燥管中的液面高度均应保持相同,反应充分进行后,如何使碱式滴定管中的液面高度与干燥管中的液面高度相同?。⑵为了保证实验结果的准确,请你将本实验过程中需直接测定的有关物理量填入下表中(用文字说明,不必填满):①②③④⑤⑥⑶上述装置还可用于证明氧化铜能加快约7%的双氧水的分解并与二氧化锰的催化效果进行比较(即比较反应速率)。用右图装置测量产生气体的体积,其他可能影响实验的因素均已忽略,相关数据如下:实验序号双氧水体积(ml)催化剂待测数据①15无②15CuO③15MnO2①从设计原理看,实验中的“待测数据”可以指;也可以指;②为探究CuO在实验②中是否起催化作用,除与①比较外,还需补做下列实验(不必写具体操作):a.证明CuO的化学性质没有改变。用心爱心专心115号编辑稀硫酸黄铜b.。用心爱心专心115号编辑4.空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02mg/L。⑴为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定。⑵乙同学拟用右图简易装置测定空气中的SO2含量:准确移取50mL5×10-4mol/L的碘溶液,注入右图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。①假设乙同学的测量是准确的,乙同学抽气的次数至少为次,方可说明该地空气中的SO2含量...