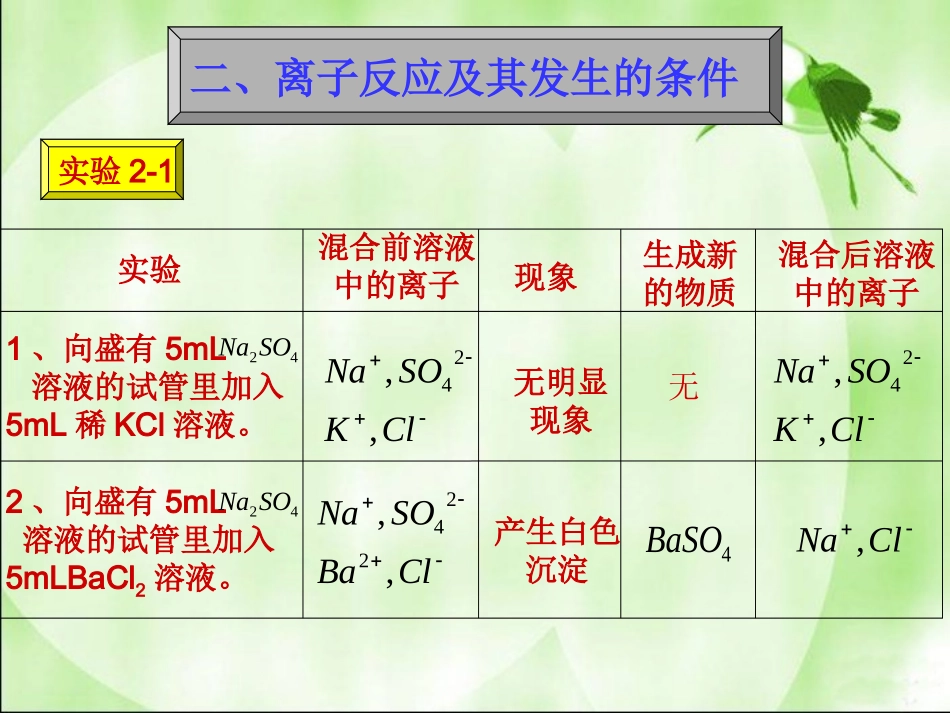
离子反应(第二课时)高一上册第二章第二节知识回顾1、什么是电解质?2、Na2SO4溶液,KCl溶液,BaCl2溶液是不是电解质?3、请写出NaHSO4,KHCO3,BaCl2在水溶液中的电离方程式。实验现象1、向盛有5mL溶液的试管里加入5mL稀KCl溶液。42SONa2、向盛有5mL溶液的试管里加入5mLBaCl2溶液。42SONa无明显现象产生白色沉淀混合前溶液中的离子混合后溶液中的离子生成新的物质ClBaSONa,,224ClKSONa,,24ClKSONa,,24无ClNa,4BaSO二、离子反应及其发生的条件实验2-1试管2发生的化学反应有:42422BaSONaClBaClSONa24422SONaSONaClBaBaCl222和4BaSONaCl实际参加反应的离子有:2Ba24SO和24SO4BaSO+==2Ba一、离子反应SO42-+Ba2+=BaSO4↓(三)、离子方程式:用实际参加反应的离子符号来表示反应的式子叫做离子反应方程式。(只有在水溶液中才能写离子方程式)(一)、定义:有离子参加或生成的反应叫做离子反应。(在水溶液中)(二)、离子反应的实质:溶液中的某些离子之间的反应(1)、离子方程式的书写步骤:①、写:写出反应的化学方程式(符合客观事实并配平)基础42422BaSONaClBaClSONa②、拆:把易溶于水且易电离的物质(溶于水的强电解质)写成离子形式,把难溶的物质、气体和水等仍用化学式来表示一般以化学式表示:难溶物、难电离物、气体、单质、氧化物(见常见的酸、碱、盐溶解性表)2)(,,OHBaNaOHKOH42422222BaSOClNaSONaClBa盐酸、硫酸、硝酸等一般以离子形式表示有强酸:强碱:大部分可溶性盐:钾盐、钠盐、铵盐、硝酸盐等对于微溶物的处理:①在生成物中有微溶物,微溶物用化学式。例:Na2S04溶液中加入AgNO3溶液2Ag++SO42-=Ag2S04↓②当反应物里有微溶物处于溶液状态(稀溶液),应写成离子形式。③当反应物里有微溶物处于浊液或固态,应写化学式。③、删:删去方程式两边没参加反应的离子。④、查:检查方程式两边各元素的原子个数和电荷总数是否相等,将系数约成最简整比。24SO4BaSO+==2Ba注意:书写离子方程式要遵守客观事实2Na++SO42-+Ba2++2Cl-====BaSO4+2Na++2Cl-凡不在溶液中进行的反应一般不能写离子方程式随堂练习①、Fe与硫酸反应制取氢气;1、写出它们的化学方程式和离子方程式。②、实验室制取;2CO3AlCl3AgNO③、溶液与溶液混合;④、澄清石灰水中通入;2CO下列离子方程式正确的是()A:铝和稀硫酸Al+2H+=Al3++H2↑B:石灰石和盐酸CO32-+2H+=CO2↑+H2OC:氢氧化钡和稀硫酸H++OH-=H2OD:铜和硝酸银溶液Cu+Ag+=Cu2++AgE:澄清的石灰水和盐酸H++OH-=H2OF:碳酸钡和稀硫酸BaCO3+2H+=Ba2++CO2↑+H2O练习E3、离子方程式正误判断的关键四查化学符号书写正误“=”、“↑、↓”是否运用恰当质量守恒和电荷守恒电子得失总数是否相等三看看反应环境:是否在溶液中进行看物质的溶解性看反应是否符合客观事实向盛有2mL稀NaOH溶液的试管中加入2mL稀盐酸现象:无明显现象OHNaClNaOHHCl2OHOHH2实验2-2OHNaClNaOHHCl2OHOHH2OHKClKOHHCl2OHOHH2OHOHH2OHOHH2OHSOKKOHSOH242422OHSONaNaOHSOH2424222、离子方程式的意义:它不仅可以表示某一个具体的化学反应,而且还可以表示同一类型的离子反应3、中和反应的实质:酸电离出来的H+和碱电离出来的OH-结合生成H2O实验1、向盛有5mL溶液的试管里加入5mL溶液。4CuSONaOH2、向盛有5mL稀溶液的试管里滴入几滴酚酞溶液,再用滴管向试管里慢慢滴入稀盐酸,至溶液恰好变色为止。NaOH3、向盛有5mL溶液的试管里加入5mL稀盐酸。32CONa现象产生蓝色沉淀红色褪去有大量的气泡冒出化学方程式和离子方程式222()CuOHCuOH2HOHHO23222HCOHOCO4224)(2SONaOHCuNaOHCuSOOHNaClNaOHHCl2223222COOHNaClCONaHCl实验2-3离子反应发生的条件:酸、碱、盐在水溶液中发生的复分解反应,实质上就是两种电解质在溶液中相互交换离子的反应。只要具备上述条件之一,反应就能发生。二、离子反应发生的条...