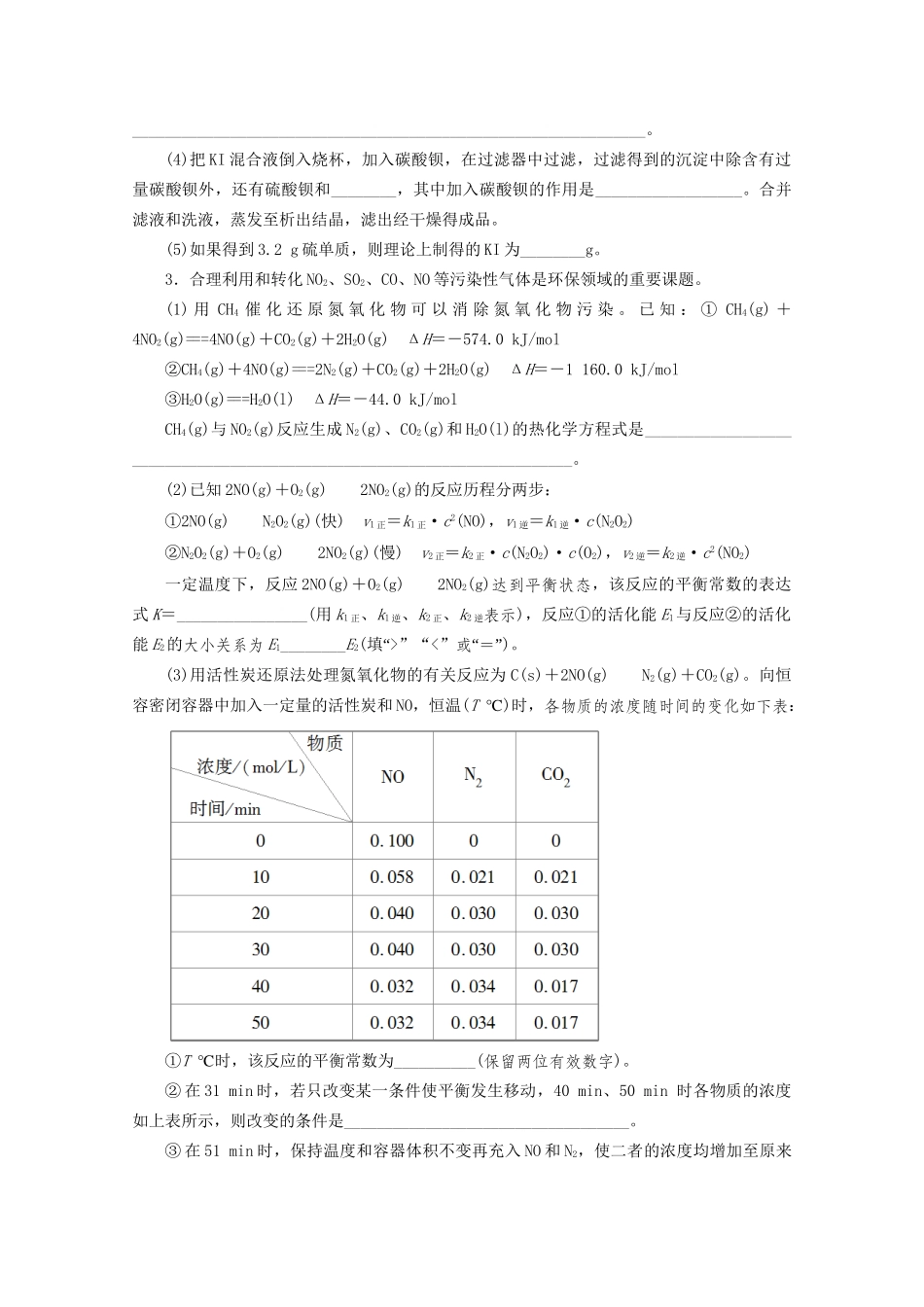
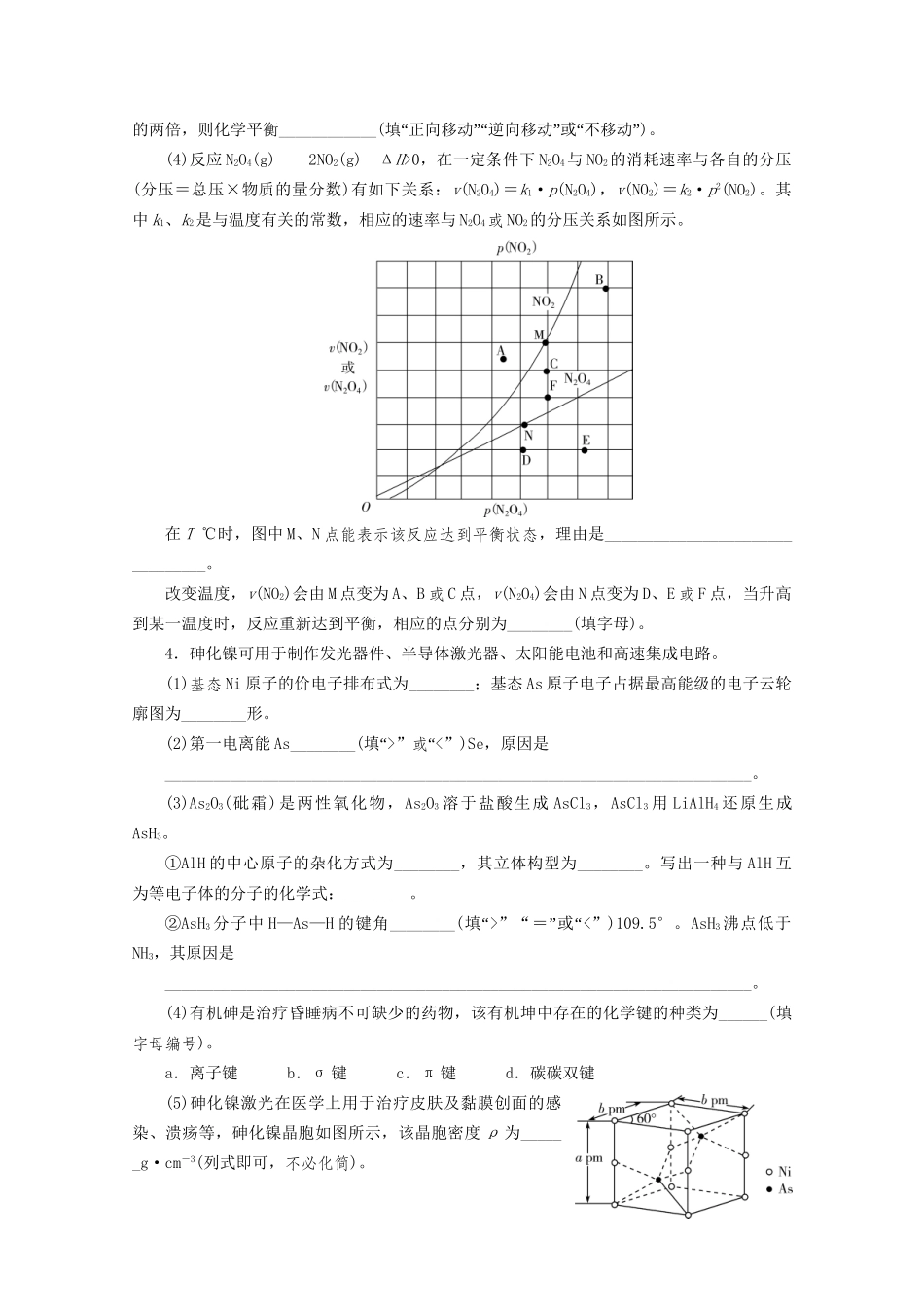
非选择题专项练(一)(建议用时:40分钟)1.铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(主要含BeO、CuS,还含少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:已知:ⅰ.铍、铝元素化学性质相似;BeCl2熔融时能微弱电离。ⅱ.常温下,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=2.1×10-13。回答下列问题:(1)滤液A的主要成分除NaOH外,还有____________(填化学式);写出反应Ⅰ中含铍化合物与过量盐酸反应的离子方程式:___________________________________。(2)滤液C中含NaCl、BeCl2和少量HCl,为得到较纯净的BeCl2溶液,选择下列实验操作最合理步骤的顺序是____________;电解熔融BeCl2制备金属铍时,需要加入NaCl,其作用是__________________。①加入过量的NaOH;②加入过量的氨水;③加入适量的HCl;④过滤;⑤洗涤。(3)反应Ⅱ中CuS的氧化产物为S单质,该反应的化学方程式为________________。(4)常温下,若滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.21mol·L-1,向其中逐滴加入稀氨水,生成沉淀F是____________(填化学式);为了尽可能多的回收铜,所得滤液G的pH最大值为____________。2.KI可用于分析试剂、感光材料、制药和食品添加剂等。制备原理如下:反应①3I2+6KOH===KIO3+5KI+3H2O;反应②3H2S+KIO3===3S↓+KI+3H2O。按照下列实验过程,请回答有关问题。(1)启普发生器中发生反应的化学方程式为______________________________________,用该装置还可以制备________(填一种气体化学式)。(2)关闭启普发生器活塞,打开滴液漏斗的活塞,滴入30%的KOH溶液,待观察到__________________(填现象)时,停止滴入KOH溶液;然后________________(填操作),待KIO3混合液和NaOH溶液中气泡速率接近相同时停止通气。(3)打开滴液漏斗的活塞,滴入硫酸溶液,并对KI混合液水浴加热,其目的是________________________________________________________________________。(4)把KI混合液倒入烧杯,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还有硫酸钡和________,其中加入碳酸钡的作用是__________________。合并滤液和洗液,蒸发至析出结晶,滤出经干燥得成品。(5)如果得到3.2g硫单质,则理论上制得的KI为________g。3.合理利用和转化NO2、SO2、CO、NO等污染性气体是环保领域的重要课题。(1)用CH4催化还原氮氧化物可以消除氮氧化物污染。已知:①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)ΔH=-574.0kJ/mol②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)ΔH=-1160.0kJ/mol③H2O(g)===H2O(l)ΔH=-44.0kJ/molCH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式是________________________________________________________________________。(2)已知2NO(g)+O2(g)2NO2(g)的反应历程分两步:①2NO(g)N2O2(g)(快)v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2)②N2O2(g)+O2(g)2NO2(g)(慢)v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2)一定温度下,反应2NO(g)+O2(g)2NO2(g)达到平衡状态,该反应的平衡常数的表达式K=________________(用k1正、k1逆、k2正、k2逆表示),反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(“填>”“<”“”或=)。(3)用活性炭还原法处理氮氧化物的有关反应为C(s)+2NO(g)N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)时,各物质的浓度随时间的变化如下表:①T℃时,该反应的平衡常数为__________(保留两位有效数字)。②在31min时,若只改变某一条件使平衡发生移动,40min、50min时各物质的浓度如上表所示,则改变的条件是___________________________________。③在51min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,则化学平衡____________(“填正向”“”“”移动逆向移动或不移动)。(4)反应N2O4(g)2NO2(g)ΔH>0,在一定条件下N2O4与NO2的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(N2O4)=k1·p(N2O4),...