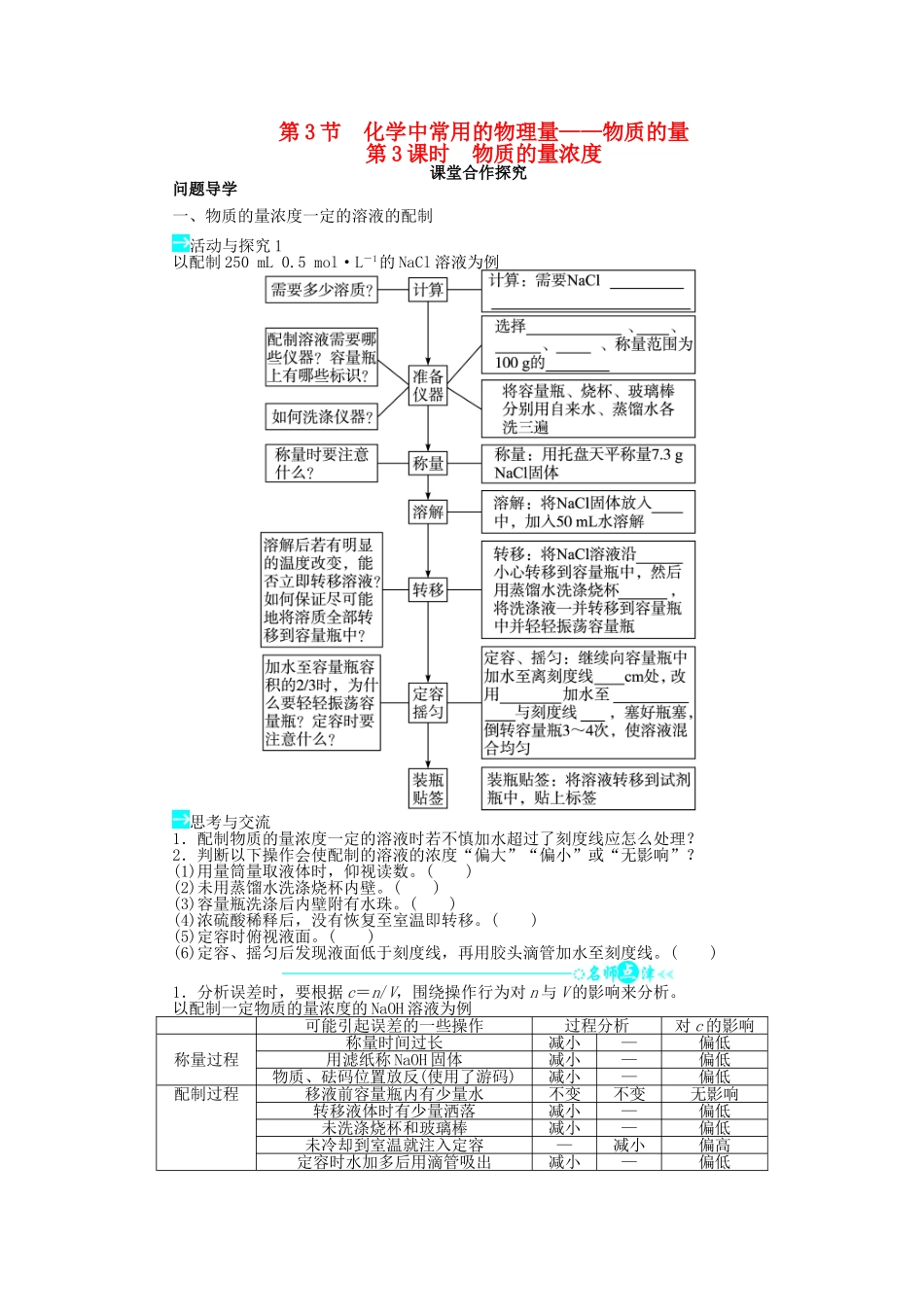
第 3 节 化学中常用的物理量——物质的量第 3 课时 物质的量浓度课堂合作探究问题导学一、物质的量浓度一定的溶液的配制活动与探究 1以配制 250 mL 0.5 mol·L-1的 NaCl 溶液为例思考与交流1.配制物质的量浓度一定的溶液时若不慎加水超过了刻度线应怎么处理?2.判断以下操作会使配制的溶液的浓度“偏大”“偏小”或“无影响”?(1)用量筒量取液体时,仰视读数。( )(2)未用蒸馏水洗涤烧杯内壁。( )(3)容量瓶洗涤后内壁附有水珠。( )(4)浓硫酸稀释后,没有恢复至室温即转移。( )(5)定容时俯视液面。( )(6)定容、摇匀后发现液面低于刻度线,再用胶头滴管加水至刻度线。( )1.分析误差时,要根据 c=n/V,围绕操作行为对 n 与 V 的影响来分析。以配制一定物质的量浓度的 NaOH 溶液为例可能引起误差的一些操作过程分析对 c 的影响称量过程称量时间过长减小—偏低用滤纸称 NaOH 固体减小—偏低物质、砝码位置放反(使用了游码)减小—偏低配制过程移液前容量瓶内有少量水不变不变无影响转移液体时有少量洒落减小—偏低未洗涤烧杯和玻璃棒减小—偏低未冷却到室温就注入定容—减小偏高定容时水加多后用滴管吸出减小—偏低定容摇匀后液面下降再加水—增大偏低定容时俯视刻度线—减小偏高定容时仰视刻度线—增大偏低2.容量瓶使用六忌:(1)一忌用容量瓶进行溶解(体积不准确);(2)二忌直接往容量瓶倒液(洒到外面);(3)三忌加水超过刻度线(浓度偏低);(4)四忌读数仰视或俯视(仰视浓度偏低,俯视浓度偏高);(5)五忌不洗涤玻璃棒和烧杯(浓度偏低);(6)六忌标准液存放于容量瓶(容量瓶是量器,不是容器)。二、有关物质的量浓度的计算活动与探究 2实验室用质量分数为 98%、密度为 1.84 g·cm-3的浓硫酸来配制 500 mL 1 mol· L-1的稀硫酸,则(1)浓硫酸的物质的量浓度为多少?( 2)所需浓硫酸的体积是多少?思考与交流若将 0.1 mol Na2O 溶于水得到 1 L 溶液,则所得溶液的物质的量浓度是否为 0.1 mol·L-1?1.溶液稀释前后,溶质的物质的量和溶质的质量都不发生变化。即 c1V1=c2V2;m1w1=m2w2。2.一般根据 V=计算溶液的体积。3.根据 M=来确定物质的相对分子质量或相对原子质量是高中阶段经常使用的方法。当堂检测1.如图表示配制一定物质的量浓度的 NaCl 溶液的部分操作示意图,其中有错误的是( )2.下列有关 0.1 mol·L-1 NaOH 溶液的叙述正确的是( )A.1 L 该溶液中含有 NaOH 40 gB....