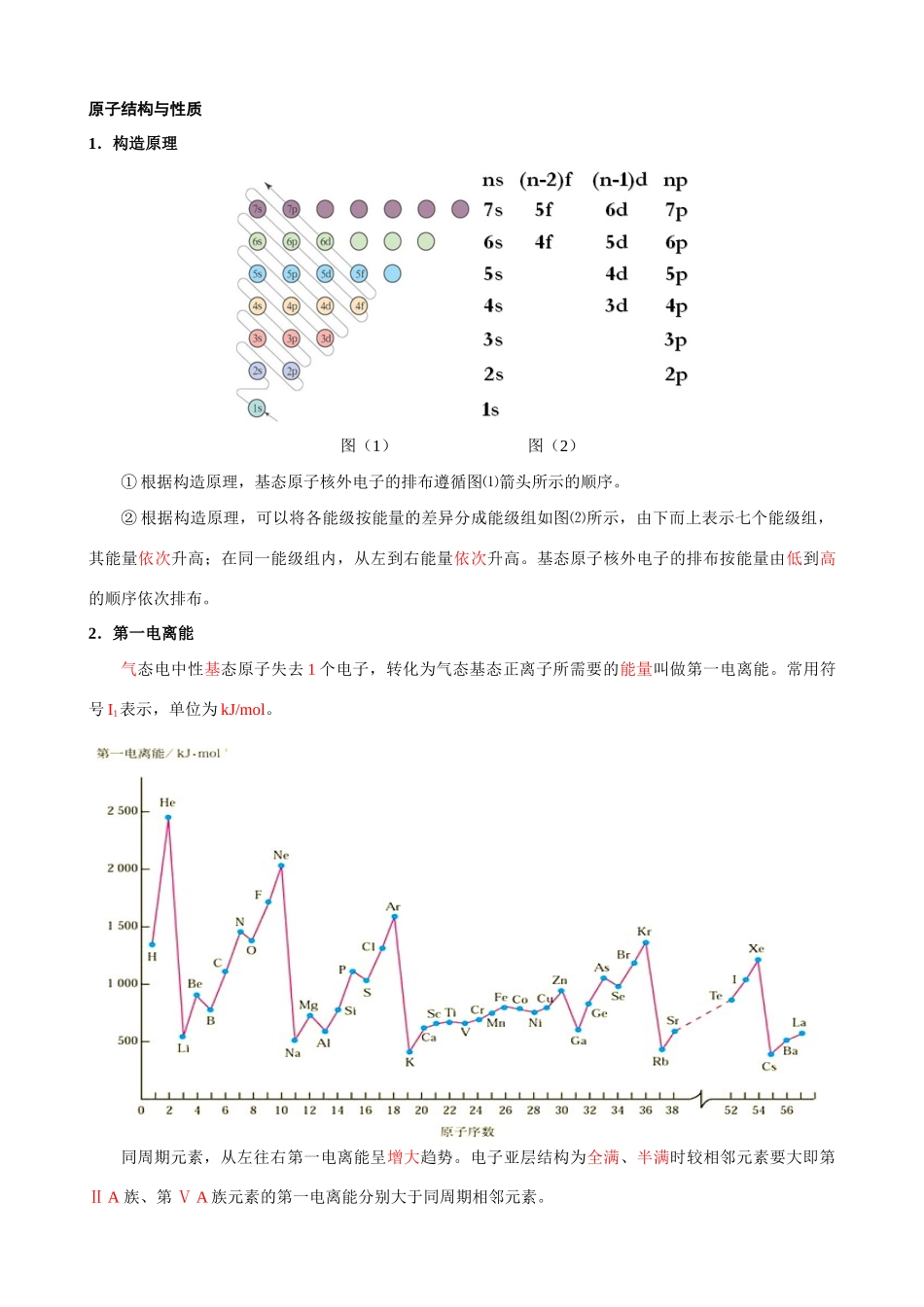
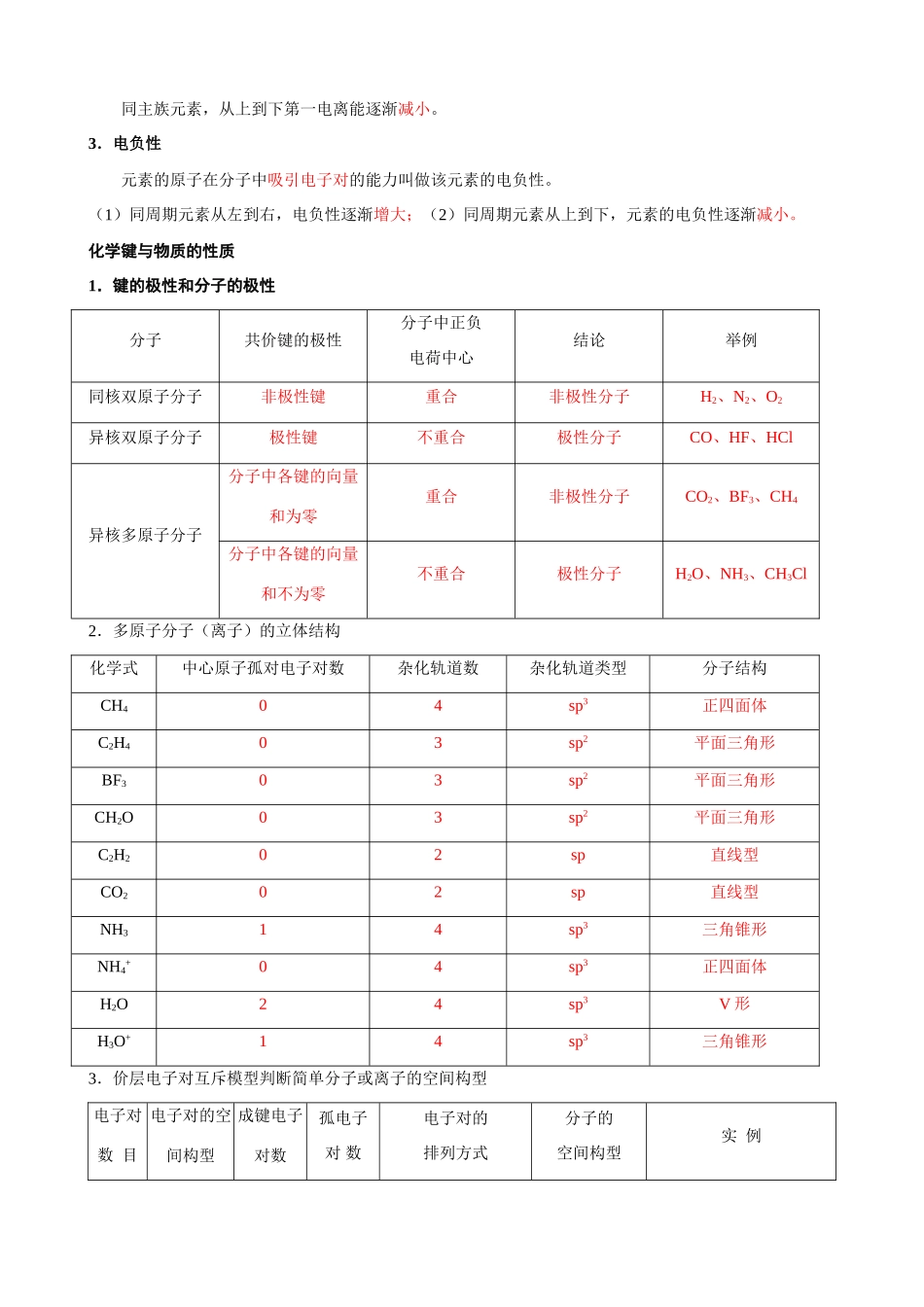
专题 10 物质结构与性质【考试要求】 原子结构与性质了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示常见元素(1~36 号)原子核外电子的排布。了解同一周期、同一主族中元素电离能和电负性的变化规律。化学键与物质的性质了解共价键的主要类型 σ 键和 π 键,能用键能、键长、键角等数据说明简单分子的某些性质(对 σ 键和 π 键之间相对强弱的比较不作要求)。了解极性键和非极性键,了解极性分子和非极性分子及其性质的差异。能根据杂化轨道理论和价层电子对互斥模型判断简单分子或离子的空间构型(对 d 轨道参与杂化和AB5 型以上复杂分子或离子的空间构型不作要求)。了解“等电子原理”的含义,能结合实例说明“等电子原理”的应用。了解简单配合物的成键情况(配合物的空间构型和中心原子的杂化类型不作要求)。了解 NaCl 型和 CsCl 型离子晶体的结构特征。能根据离子化合物的结构特征和晶格能解释离子化合物的物理性质。了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。理解金属键的含义,能用金属键的自由电子理论解释金属的一些物理性质。知道金属晶体的基本堆积方式,了解常见金属晶体的晶胞结构(晶体内部空隙的识别、与晶胞的边长等晶体结构参数相关的计算不作要求)。分子间作用力与物质的性质知道分子间作用力的含义,了解化学键和分子间作用力的区别。知道分子晶体的含义,了解分子间作用力的大小对物质某些物理性质的影响。了解氢键的存在对物质性质的影响(对氢键相对强弱的比较不作要求)。了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别。【命题趋势】本专题考查表现为一道独立的综合题,约占 12 分。覆盖原子结构、分子结构、晶体结构等核心概念,知识点全面,但整体难度不大。 【要点梳理】 南京市 2008 届高三化学二轮复习专题教学案样稿20080201原子结构与性质1.构造原理图(1) 图(2)① 根据构造原理,基态原子核外电子的排布遵循图⑴箭头所示的顺序。② 根据构造原理,可以将各能级按能量的差异分成能级组如图⑵所示,由下而上表示七个能级组,其能量依次升高;在同一能级组内,从左到右能量依次升高。基态原子核外电子的排布按能量由低到高的顺序依次排布。2.第一电离能气态电中性基态原子失去 1 个电子,转化为气态基态正离子所需要的能量叫做第一电离能。常用符号 I1...